
【题目】下列说法正确的是( )
A.熔点:![]()
B.第一电离能:![]()
C.18g冰中含有![]() 个氢键
个氢键
D.基态原子价电子排布式为![]() 的元素的氢氧化物能使氢氧化铝溶解
的元素的氢氧化物能使氢氧化铝溶解
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】I.按要求填空:
(1)浓度均为0.1mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵,四种溶液中由水电离出的H+浓度由大到小的顺序是________(填序号)。
(2)现将足量的固体AgCl分别放入下列物质中:①30mL0.02mol/LCaCl2溶液 ②20mL0.01mol/LKCl溶液 ③40mL0.03mol/LHCl溶液 ④10mL蒸馏水 ⑤50mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的排列顺序是______(填序号)。
(3)Na2CO3溶液中离子浓度由大到小的顺序为________。
(4)CuSO4溶液中含有Fe2(SO4)3杂质,除杂试剂为________。
(5)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________。
(6)将25℃下pH=12的Ba(OH)2溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=________。(溶液体积变化忽略不计)。
II.常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________。
(2)Na2A的水溶液呈________性,原因是(用离子方程式表示):________。
(3)若溶液M由2mol/LH2A溶液与2mol/LNaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为________。
(4)已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为_______mol·L-1。(忽略A2-的水解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJmol-1
2NO(g) △H=+180.5kJmol-1
③4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) △H=+l025kJmol-1
4NH3(g)+5O2(g) △H=+l025kJmol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
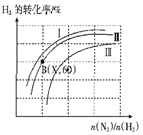
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3 从高到低的顺序是_________________;测得B(X,60)点时N2的转化率为50%,则X=________。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应2X(g)+Y(g)![]() Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )
Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )

A. 增大压强B. 升高温度C. 加催化剂D. 增大生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将0. 3 mol CO2通入盛有23.4 gNa2O2的容器中,一段时间后排出气体,所得固体的质量为29. 0 g,则参加反应的CO2的物质的量与产物Na2CO3的质量分别为( )
A.0. 3 mol 29. 0 gB.0. 3 mol 21. 2 g
C.0. 2 mol 21. 2 gD.0. 2 mol 29. 0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10molA和5molB放入容积为10L的密闭容器中,某温度下发生反应:3A(g)+B(g)![]() 2C(g),在最初2s内,消耗A的平均速率为0.09mol·L-1·s-1,则在2s时,
2C(g),在最初2s内,消耗A的平均速率为0.09mol·L-1·s-1,则在2s时,
(1)容器中有___________molA;
(2)此时C的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知红热的铁能与水蒸气反应生成氢气。现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题。
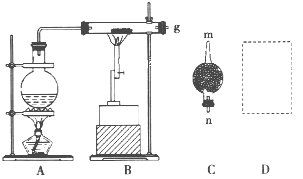
(1)写出铁在高温下与水蒸气反应的化学方程式:____________________________。
(2)干燥管C中盛放的药品是__________,干燥管的_______(填“m”或“n”)端与g导管相连接。
(3)在D处画出用试管收集氢气的装置图(所需其他仪器自行选择)。______________
(4)怎样用简单的方法检验收集到的气体是氢气?简述实验操作步骤和现象:______________。
(5)若收集到标准状况下的![]() 22.4L,则参加反应的铁粉的质量为__________g。
22.4L,则参加反应的铁粉的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. C生成的速率是A反应速率的2倍
B. A、B、C的浓度不再变化
C. 单位时间内生成nmol A,同时生成3nmol B
D. A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com