
【题目】已知某硫铁矿烧渣的主要化学成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计了不同的方案,进行金属元素的提取实验。
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分別为3.7、5.2、8.8、12.4。 方案一(如图1):

请回答:
(1)写出固体E的化学式:_______。试剂①是_______ (填序号)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是____(填序号)。
A.石蕊试液 B.广泛pH试纸 C. pH计
(3)写出由溶液F→固体G的过程中,反应的离子方程式:____________。
方案二(如图2):

由烧渣制备绿矾(FeSO4·7H2O),再由绿矾制备乳酸亚铁{[CH3CH(OH)COO]2Fe·3H2O,M=288.0g/mol}是一种新型的优良补铁剂,绿白色晶体,溶于水,几乎不溶于乙醇;涉及下列反应:
FeSO4 + Na2CO3=FeCO3↓+Na2SO4,
2CH3CH(OH)COOH+ FeCO3+2 H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
(4)试剂X是_________。
(5)在室温下,将所得的乳酸亚铁成品用无水乙醇进行浸泡2次,从而得到精制产品。选择用无水乙醇进行浸泡的优点是________________(写出两点)。
(6)该学习小组同学用KMnO4滴定法测定样品中Fe2+的量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是________________。
经查阅文献后,小组同学改用Ce(SO4)2标准溶液滴定法进行测定。反应中Ce4+的还原产物为Ce3+。 测定时.称取3.0g样品,溶于水配成100mL溶液,每次取20.00mL的溶液用0.1000mol/L Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
滴定次数 | 0.l000mol/L Ce(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁的纯度为______(以质量分数表示)。
【答案】 Mg(OH)2 A C AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe粉 可去除产品表面的有机杂质、降低产品的溶解损耗、乙醇易挥发便于干燥等 羟基被酸性高锰酸钾溶液氧化 94.6%
【解析】(1)根据硫铁矿烧渣的成分为SiO2、Fe2O3、Al2O3、MgO,结合这四种氧化物的性质进行判断,固体A是二氧化硅,结合有关信息判断,固体C为Fe(OH)3,固体E为Mg(OH)2,固体G为Al(OH)3,试剂①为NaOH。故答案为:Mg(OH)2;A;
(2)要准确测定溶液的pH,应选pH计,故答案为:C;
(3)偏铝酸钠溶液与过量二氧化碳反应的离子方程式为![]() +CO2+2H2O=Al(OH)3↓+ HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
+CO2+2H2O=Al(OH)3↓+ HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)把Fe3+还原为Fe2+,并且为了不引入新杂质,试剂X应该选用Fe粉,故答案为:Fe粉;
(5)结合信息,在室温下,将所得的乳酸亚铁成品用无水乙醇进行浸泡2次,从而得到精制产品。选择用无水乙醇进行浸泡的优点是可去除产品表面的有机杂质、降低产品的溶解损耗、乙醇易挥发便于干燥等,故答案为:可去除产品表面的有机杂质、降低产品的溶解损耗、乙醇易挥发便于干燥等;
(6)羟基被酸性高锰酸钾溶液氧化,消耗更多的高锰酸钾溶液,导致所测纯度偏大;根据表格数据,第二次的实验结果误差较大,删除,消耗标准溶液的体积平均为![]() =19.70mL;由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.1000mol/L×0.0197L=0.00197mol,故100mL含有n(Fe2+)=0.00197mol×
=19.70mL;由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.1000mol/L×0.0197L=0.00197mol,故100mL含有n(Fe2+)=0.00197mol×![]() =0.00985mol,故产品中乳酸亚铁晶体的质量分数为
=0.00985mol,故产品中乳酸亚铁晶体的质量分数为![]() ×100%=94.6%,故答案为:羟基被酸性高锰酸钾溶液氧化;94.6%。
×100%=94.6%,故答案为:羟基被酸性高锰酸钾溶液氧化;94.6%。


科目:高中化学 来源: 题型:
【题目】列实验操作能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 比较水和乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
B | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
D | 证明SO2具有漂白性 | 把SO2通入紫色石蕊试液中 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乳酸的结构简式为CH3CH(OH)COOH,试回答下列问题:
(1)乳酸分子中含有两种官能团的名称是________,试写出一种与乳酸含有相同官能团的同分异构体的结构简式:____________。
(2)乳酸与氢氧化钠溶液反应的化学方程式:_______________________________。
(3)乳酸与足量的金属钠反应的化学方程式:__________________________________。
(4)乳酸与乙醇发生酯化反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用MnO2 与浓盐酸反应制备Cl2(装置如图所示)。

(1)制备实验开始时,先检査装置气密性,接下来的操作依次是:____________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,甲同学提出:与足量AgNO3溶液反应,称量生成的AgCl沉淀质量。方案不可行,原因是_________。请你选择一种最佳的实验方法____________________(填编号)。
A.沉淀法 B.气体法 C.滴定法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:

(1)A的结构简式为_____,B中官能团的电子式为____,D中官能团的名称为_________。
(2)反应①的反应类型是________,反应③的化学方程式为:_______________。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,
待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是__________________________________________。该反应的化学方程式为_____________。

(4)D与碳酸氢钠溶液反应的离子方程式为______________________________。
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
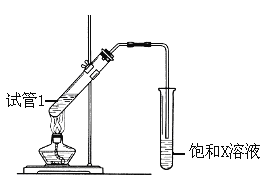
图中X的化学式为_________。浓硫酸的作用是__________。
该反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中,正确的是( )
A. 有单质参加的反应一定是氧化还原反应
B. 燃烧反应必须有氧气作氧化剂
C. 2Fe+3Cl2=2FeCl3, Fe+S![]() FeS 由此可以判断氧化性:Cl2>S
FeS 由此可以判断氧化性:Cl2>S
D. Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子 ,因此还原性Al>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有以下物质相互转化,其中B溶液为浅绿色,I溶液为棕黄色,J为AgCl,请回答:

(1)C是(填化学式)_____,F的化学式_____.
(2)写出B的化学式______,检验B中阳离子的操作方法是__________________.(只填一种方法,用文字表述)
(3)写出由G转变成H的化学方程式_______________________.
(4)写出检验I溶液中阳离子的离子方程式________________;向I溶液中加入单质Cu的有关离子反应方程式是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;1/2H2SO4(浓)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是
A. 上述热化学方程式中的计量数表示分子数
B. ΔH1>ΔH2
C. ΔH2=-57.3 kJ·mol-1
D. |ΔH1|>|ΔH2|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述,错误的是
A. 任何可逆反应都有一定的限度
B. 化学反应的限度与时间的长短无关
C. 化学反应的限度是不可改变的
D. 化学反应达到限度时,正逆反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com