
����Ŀ����1��3.1 g Na2X����Na�� 0.1 mol����Na2X��Ħ������Ϊ________��X�����ԭ������Ϊ________��
��2��ͬ��ͬѹ�£�ͬ����ļ��������������֮��Ϊ_______��ԭ�Ӹ���֮��Ϊ_____������֮��Ϊ_________��������֮��Ϊ________��
��3���õ������0.1 mol��L��1��BaCl2��Һ����ʹ��ͬ�����Fe2(SO4)3��Na2SO4��Al2(SO4)3������Һ�е�SO42-��ǡ����ȫ�����������������ε����ʵ���Ũ��֮��Ϊ_____��
���𰸡�62g/mol 16 1��1 5��2 8��1 5��1 1��3��1
��������
��1������M=m/n���м��㣻
��2��ͬ��ͬѹ�£����֮�ȵ������ʵ���֮�ȣ��ٸ���ԭ�ӽṹ���м��㣻
��3������SO42+Ba2+=BaSO4�����м��㡣
��1��һ�� Na2X���ж���Na�� ��0.1 mol Na��ʱ��Na2X�����ʵ���Ϊ0.05mol��������Ϊ3.1 g����M=m/n=3.1/0.05=62g/mol��X�����ԭ������=62-23![]() 2=16��
2=16��
��2��ͬ��ͬѹ�£����֮�ȵ������ʵ���֮�ȣ���ͬ����ļ��������������֮��Ϊ1��1��һ����������к���5��ԭ�ӣ�һ�����������к���2��ԭ�ӣ���ͬ����ļ��������ԭ�Ӹ���֮��Ϊ5��2�������Ħ������Ϊ16g/mol��������Ħ������Ϊ2g/mol�����ʵ������ʱ������֮��Ϊ16��2=8��1����������к��еĵ�����Ϊ10�������к��еĵ�����Ϊ2���������֮��Ϊ5��1��
��3������SO42+Ba2+=BaSO4�����������0.1 mol��L��1��BaCl2��Һ��n��Ba2+����ͬ�����ĵ�n��SO42����ͬ����n[Fe2(SO4)3]�� n��Na2SO4���� n[Al2(SO4)3]=![]() ��1��
��1��![]() =1��3��1��
=1��3��1��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý�������ʵ�飺��������Һ�������У�Ԥ���������ʵ���������

ѡ�� | �������� | �������� | Ԥ�����е����� |
A�� | ϡ���� | ̼�������������ƵĻ����Һ | ������������ |
B�� | Ũ���� | ��ɰֽ��ĥ�������� | ��������ɫ���� |
C�� | �Ȼ�����Һ | Ũ����������Һ | ����������ɫ���� |
D�� | ������Һ | �������������Һ | ��Һ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��Ԫ�ض�ֲ�����������彡������ʮ����Ҫ�����ã���Ļ����ﱻ�㷺Ӧ�����²����Ʊ��������������������
��1��������ԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ͺ���ߵķֱ�Ϊ________��________�����ţ�
A��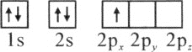
B��
C��
D��
��2�������������Է����ֳ�����ʮ����Ķ��������Σ��������ʳ�Ϊ�����________��
��3����Ԫ�صļ��⻯��BH3����������ڣ����������γɽ��ȶ���B2H6�����������ӽ�ϡ�
��B2H6���ӽṹ��ͼ����Bԭ�ӵ��ӻ���ʽΪ________��

�ڰ����飨NH3BH3������Ϊ�����DZ�������ʹ������֮һ�������д�����λ�����ṩ�µ��ӶԵijɼ�ԭ����________��д��һ���백���黥Ϊ�ȵ�����ķ���________���ѧʽ����
��4�������ᣨH3BO3��Ϊԭ�Ͽ��Ƶ����⻯�ƣ�NaBH4���������л��ϳ��е���Ҫ��ԭ����
��H3BO3�����е�Ԫ�ṹ��ͼ����ʾ������Ԫ�е���ԭ��ͨ��________������á�A��B��C����ʾ��A��B��C��ʾԭ�ӣ�����ɲ�״�ṹ����Ƭ��ṹ��ͼ����ʾ�������֮����________�������������ƣ����Ϲ����������ᾧ�塣

�����⻯����![]() �ļ��Ǵ�С��________�����幹��Ϊ________��
�ļ��Ǵ�С��________�����幹��Ϊ________��
�۸��������ṹ�ж�����˵����ȷ����________
a��H3BO3���ӵ��ȶ���������й�
b�����ᾧ���л���У�������
c��H3BO3��������ԭ�������Ϊ8e���ȶ��ṹ
d����1mol H3BO3�ľ�������3 mol���
��5������BP�����ܸ߶ȹ�ע����ĥ���ϣ�����Ϊ��������ı����㣬��ṹ����ʯ���ƣ������ṹ��ͼ��ʾ��������z����ƽ���ͶӰͼ�У�Bԭ�ӹ��ɵļ�����״��________����֪�����߳�Ϊa pm������������ܶ���________g��cm��3���г���a��NA�ļ���ʽ���ɣ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������ʾ��װ���У��ձ���ʢ�ŵ���Ba(OH)2��Һ�����ӵζ���������ij����ҺAʱ����Һ�ĵ����Եı仯������ͼ��������ʾ��

��1���μ�Һ����ͼ��������������͵�ʱ�����ݿ���Ϩ����ҺA�к��е����ʿ����ǣ�����ţ�__________��
��HCl ��H2SO4 ��NaHSO4 ��NaHCO3
��2����֪0.1 mol��L-1NaHSO4��Һ��c(H��)=0.1 mol��L-1����ش��������⣺
��д��NaHSO4��ˮ��Һ�еĵ��뷽��ʽ_______________________________��
��NaHSO4����________������������������������������
����NaHSO4��Һ�У���μ���Ba(OH)2��Һ�����ԣ���д��������Ӧ�����ӷ���ʽ��_______��������������Һ�У������μ�Ba(OH)2��Һ_______��
��3����һ���Լ���ȥ���и������е�����(�����ڵ�����)��д�����õ��Լ�����Ӧ�����ӷ���ʽ��
��.CaCl2(HCl)���Լ�______�������ӷ���ʽ___________��
��.O2(CO2)���Լ�______�����ӷ���ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е����Ų�ͼ����ʾ��Ԫ��ԭ���У��������������״̬���� (����)

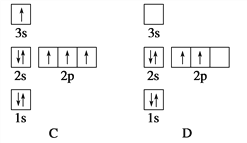
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л����˵����ȷ����( )
A. C2H5COOC2H5����C4H9COOHʱ���Լ��뱥��Na2CO3��Һ���Һ��ȥ
B. ������Ҳ��2-������
C. ����ʽΪC5H12O����������Ʒ�Ӧ����������л����ͬ���칹�干��9��
D. ��������ˮ���𱽡��Ҵ������Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����SO2ͨ������ˮ��ģ�������γɹ��̣�ʵ��������ͼ����֪Ka1(H2SO3)=10��2��Ka2(H2SO3)=10��7������˵������ȷ����

A. 300sδͨO2ʱ��Һ��c(H2SO3)=10 ��5.46mol��L��1
B. 400sʱ��Һ��c(HSO3��)+c(SO32��)+c(SO42��)+c(H2SO3)��10��3.73mol��L��1
C. 600sʱ����Һ��c(H+)ԼΪc(SO42��)2��
D. ��ͼ��֪��H2O2�����Դ���O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¿���������������������������������齺�����Դ�����֬�ȡ���3-��-3-��ϩ��ϳ��¿����������·��������ʾ��

�ش��������⣺
(1)B�еĺ��������ŵ�������______________________������ķ���ʽΪ___________��
(2)��Ӧ�١��ݵķ�Ӧ���ͷֱ���__________��____________����Ӧ������ķ�Ӧ����Ϊ___________��
(3)��Ӧ�ݵĻ�ѧ����ʽΪ_________________________________��
(4)�¿����ͬ���칹���У�����̼̼˫������NaHCO3��Һ�������壬���ܷ���������Ӧ��ˮ�ⷴӦ����__�֡�
(5)![]() �ͱ��״��ɺϳ�
�ͱ��״��ɺϳ� �����ºϳ�·�߲�������(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ�����) ______________��
�����ºϳ�·�߲�������(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ�����) ______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��M��ĵ�������L���������1/2�����Ԫ�ص�ԭ���ǣ� ��
A. LiB. SiC. AlD. K
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com