
【题目】在100℃时,将0.1mol的四氧化二氮气体充入1 L抽空的密闭容器中,发生反应,隔一定时间对该容器内的物质进行分析,得到如下数据:
浓度 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L—1 | 0.1 | c1 | 0.05 | c3 | a | b |
c(NO2)/mol·L—1 | 0 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
(1)该反应的化学方程式为______________________,表中c2_____c3_____a______b(选填“>”、“<”、“==”)。
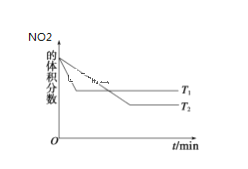
(2)20 s时四氧化二氮的浓度c1=____________mol·l—1依据图象可以判断该反应的 ΔH___0(填“>”或“<”)
【答案】N2O4![]() 2NO2 > = = 0.07 >
2NO2 > = = 0.07 >
【解析】
(1)四氧化二氮反应生成二氧化氮,其反应的化学方程式为N2O4![]() 2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡。
2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡。
(2)20 s时二氧化氮物质的量浓度改变量为0.06 mol·L-1,则四氧化二氮物质的量浓度改变量为0.03 mol·L-1,则此时四氧化二氮物质的量浓度c1=0.1 mol·L-1 – 0.03 mol·L-1 =0.07 mol·L-1,依据图象先拐先平衡,数字大,得出T1 > T2,从下到上,升温,二氧化氮体积分数变大,说明是正向移动,即升温正向移动,正向是吸热反应,即ΔH>0。
(1)四氧化二氮反应生成二氧化氮,其反应的化学方程式为N2O4![]() 2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡,因此表中c2>c3=a=b,故答案为:N2O4
2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡,因此表中c2>c3=a=b,故答案为:N2O4![]() 2NO2;>;=;=。
2NO2;>;=;=。
(2)20 s时二氧化氮物质的量浓度改变量为0.06 mol·L-1,则四氧化二氮物质的量浓度改变量为0.03 mol·L-1,则此时四氧化二氮物质的量浓度c1=0.1 mol·L-1 – 0.03 mol·L-1 =0.07 mol·L-1,依据图象先拐先平衡,数字大,得出T1 > T2,从下到上,升温,二氧化氮体积分数变大,说明是正向移动,即升温正向移动,正向是吸热反应,即ΔH>0,故答案为:0.07;>。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)H2S在水中的电离方程式为 。
(1)向H2S溶液中加入浓盐酸时,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(2)向H2S溶液中加入NaOH固体,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入 。
(4)向H2S溶液中加水,c(HS-) (填增大、减小、不变),溶液pH (填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应2Mg+CO2![]() 2MgO+C ΔH<0从熵变角度看,可自发进行
2MgO+C ΔH<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7, Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B(g)=2C (g)+D(g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka:醋酸根水解常数为Kb;水的离子积为Kw:则三者关系为:KaKb=Kw
⑥反应A(g)=2B(g) △H,若正反应的活化能为EakJmol-1,逆反应的活化能为EbkJmol-1,则△H=(Ea-Eb)kJmol-1上述归纳正确的是( )
A.全部B.③④⑤⑥C.②④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变细,N棒变粗,其中P为电解质溶液。由此判断M、N、P所代表的物质不可能是( )

M | N | P | |
A | Zn | Cu | 稀硫酸 |
B | Fe | Cu | 硫酸铜溶液 |
C | Zn | Ag | 硝酸银溶液 |
D | Zn | Fe | 硝酸铜溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是.![]()
A.在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有![]()
B.测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差
C.灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行
D.实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和![]() 在一定条件下制备
在一定条件下制备![]() 的反应为:
的反应为:![]() ,在体积为1L的恒容密闭容器中,充入
,在体积为1L的恒容密闭容器中,充入![]() 和
和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。

①从反应开始至达到平衡,用氢气表示的平均反应速率![]() ______
______![]() 。
。
②下列说法正确的是______![]() 填字母序号
填字母序号![]() 。
。
A.达到平衡时,CO的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前![]() 正
正![]() 逆
逆![]() ,2min后
,2min后![]() 正
正![]() 逆
逆![]()
③该条件下反应的平衡常数![]() ______。
______。
(2)已知:Ⅰ![]() 的燃烧热为
的燃烧热为![]()
Ⅱ![]()
![]()
![]()
Ⅲ.![]()
![]()
则①![]() ______。
______。
②对于可逆反应![]() 采取以下措施可以提高
采取以下措施可以提高![]() 产率的是______
产率的是______![]() 填字母
填字母![]()
A.降低体系的温度B.压缩容器的体积
C.减少水量D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:![]() ,则充电时的阳极反应式为______。
,则充电时的阳极反应式为______。
(4)若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______![]() 填序号
填序号![]() 。
。

①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③![]() 的电离平衡常数:b点>a点
的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com