
【题目】(1)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有好的电学性能。下列说法正确的是_____ (填序号)。
A.金属Ca、Sr、Ba采用体心立方堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子

(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构如图所示。
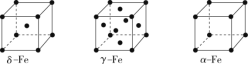
①γ—Fe晶胞中含有的铁原子数为_____。—
②δ—Fe、α—Fe两种晶体中铁原子的配位数之比为_____。
③若α—Fe晶胞的边长为acm,γ—Fe晶胞的边长为bcm,则两种晶体的密度之比为_____。
【答案】B 4 4:3 ![]()
【解析】
根据晶胞结构,用均摊法时行分析。
(1)A.由晶胞结构可知,A位于晶胞的8个顶点,故金属Ca、Sr、Ba采用的是简单立方堆积,A不正确;
B.由晶胞结构可知,晶胞中含有A的数目为![]() ,含有B的数目为
,含有B的数目为![]() ,含有O的数目为
,含有O的数目为![]() ,故用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3,B正确;
,故用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3,B正确;
C.金属键没有方向性,故金属在发生形变后,金属键仍存在。在制造Fe薄片时,金属键没有完全断裂,C不正确;
D.V、Cr、Mn、Fe晶体均为金属晶体,其中均存在金属阳离子和自由电子,无阴离子存在,D不正确。
综上所述,说法正确的是B。
(2)①γ—Fe晶胞中,Fe位于晶胞的8个顶点和6个面心,故其含有的铁原子数为![]() 。
。
②δ—Fe中,铁原子的配位数为8;α—Fe中,铁原子的配位数为6,故两种晶体中铁原子的配位数之比为8:6=4:3。
③若α—Fe晶胞的边长为acm,其晶胞中只含1个Fe原子,则晶体的密度为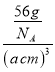 ;若γ—Fe晶胞的边长为bcm,其晶胞中含4个Fe原子,则晶体的密度为
;若γ—Fe晶胞的边长为bcm,其晶胞中含4个Fe原子,则晶体的密度为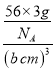 。故两种晶体的密度之比为
。故两种晶体的密度之比为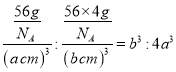 。
。


科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是
①反应速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2;②各组分的物质的量浓度不再改变;③体系的压强不变;④混合气体的密度不变 (相同状况);⑤体系的温度不再发生变化;⑥2 v(N2)(正)=v(NH3)(逆) ;⑦单位时间内有3mol H—H断裂同时有2mol N—H断裂。
A.①②③⑤⑥⑦B.②③④⑤⑥C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
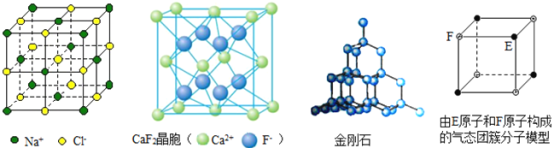
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种晶体的晶胞结构如图所示,下列有关说法正确的是( )
A.图甲所示晶体的化学式为A3B4C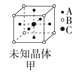
B.图乙所示晶体中阴阳离子个数比为1:1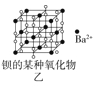
C.图丙所示CaF2晶体中Ca2+配位数为4,F-配位数为8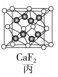
D.图丁所示晶体属于简单立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的酸性溶液中:Fe3+、Cu2+、SCN-、SO42-
B.能使酚酞变红的溶液中:K+、NH4+、Cl-、NO3-
C.![]() =10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
=10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
D.c(HCO3-)=0.1mol·L-1的溶液中:H+、Mg2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
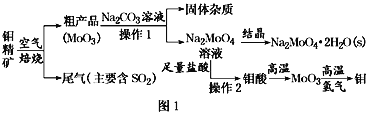
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
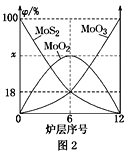
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数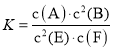 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
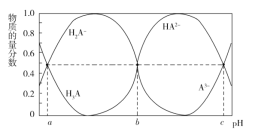
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.电子构型为[Ar]3d104s2的元素是过渡金属元素
B.某基态原子3d能级中电子排布的情况可能为![]()
C.在氢原子的电子云图中,每个小黑点代表一个电子
D.当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com