
【题目】在给定条件下,下列选项所示的物质间转化不能实现的是
A.CH4![]() H2
H2![]() H2OB.N2
H2OB.N2![]() NH3
NH3![]() NH4Cl
NH4Cl
C.Cu![]() NO2
NO2![]() HNO3D.CH2=CH2
HNO3D.CH2=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO
【答案】A
【解析】
A.CH4和Cl2光照得到CH3Cl、CH2Cl2、CHCl3、CCl4,、HCl,得不到H2,转化不能实现,A错误,符合题意;
B.N2和H2在高温高压催化剂下发生反应生成NH3,化学方程式为N2+3H2![]() 2NH3,NH3和HCl反应生成NH4Cl,B正确,不选;
2NH3,NH3和HCl反应生成NH4Cl,B正确,不选;
C.Cu和浓硝酸反应生成NO2,化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,NO2与水反应可得到HNO3,方程式为3NO2+H2O=2HNO3+NO,可以转化,C正确,不选;
C.CH2=CH2可与水发生加成反应得到CH3CH2OH,乙醇再发生催化氧化,可得到CH3CHO,可以转化,D正确,不选;
答案选A。


科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分Ca(0H)2,含Fe203、MgO和Si02等杂质]为原料制备纳米碳酸钙的—种工艺流程如下:
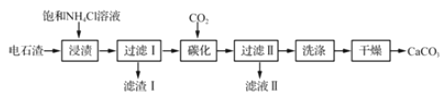
(1)电石渣溶于水形成电石渣浆时会发生反应,生成的物质中除水外还有______。
(2)“浸渍”时,NH4Cl和Ca(0H)2反应的化学方程式为______。
(3)“浸渍”时,一定时间内Ca2+浸取率随温度变化如图所示。Ca2+浸取率随温度升高而上升的原因可能是______。
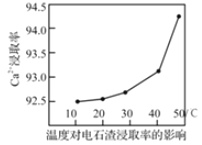
A.温度升高,增大浸取反应速率,从而提高Ca2+浸取率
B.温度升高,溶液黏稠度减小,从而提高Ca2+浸取率
C.温度升高,NH4Cl溶液水解程度减小,从而提高Ca2+浸取率
(4)“碳化”时,-般采用低温工艺,对应的离子方程式为___。
(5)滤液Ⅱ中,可循环利用的溶质的化学式为___。
(6)“洗涤”时,检验是否洗净的方法是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
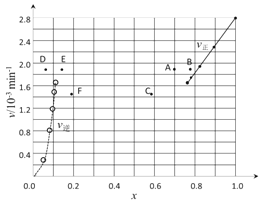
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
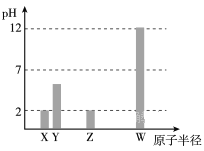
A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1molN2中含有的分子数为2×6.02×1023B.电解饱和食盐水可得到金属钠
C.常温下,铝片能溶于浓硝酸D.常温下,淀粉溶液遇I2变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.l00mol·L-1的NaOH溶液滴定10.00mL浓度均0.l00mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中洛液的电导率如下图所示。下列说法不正确的是( )
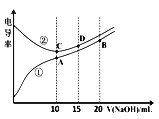
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C. 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D. B点溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1 = +92.09kJ/mol
氧化法:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) △H2
(1)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64 kJ/mol,则△H2=_______。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________。
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线____(填“a”或“b”)对应脱氢法,判断依据为_________________。

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
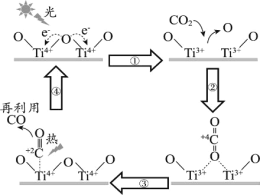
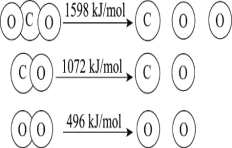
下列说法错误的是( )
A.过程①中吸收能量使钛氧键发生了断裂
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以提高化学反应速率
D.2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热30kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
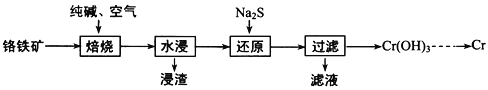
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________ 。
②“水浸”要获得浸出液的操作是_________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___________________________________________________。
(2)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+![]() Cr2O72-+ H2O)。
Cr2O72-+ H2O)。
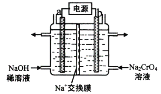
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应:______________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是_______________mol 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com