
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A.增大容器容积B.升高反应温度
C.恒容下通入乙烷D.恒容下通入惰性气体
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值、单位,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、 E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色:反应③中有水生成,反应②需要放电才能发生,A是—种极易溶于水的气体,A和D相遇有白烟生成。
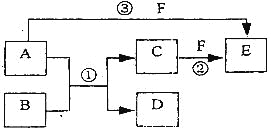
(1)反应③的化学方程式为_______________________________________________。
(2)反应①中每生成1 molC,转移的电子数为_______________________________。
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈性___________(填“酸”“碱”或“中’’),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+_________=c(OH-)+_____________;
②c(H+)=c(OH-)+_____________。
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式____________________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流。则该新型电池的正极的电极反应式为___________________________;原电池的总反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。
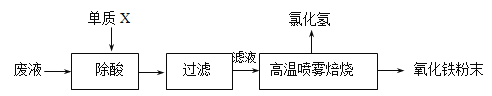
(1)单质X的化学式是___________。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:_____________________________________________________________________。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3molL-1H2SO4、0.1 molL-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤 | 预期现象和结论 |
步骤1.取少量样品于试管中,_______________ | 样品全部溶解,得到澄清的溶液。 |
步骤2.___________________ | __________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体___升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:
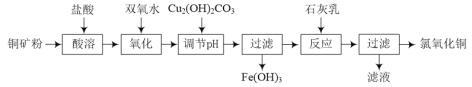
⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.溴水中存在Br2+H2OHBr+HBrO,当加入硝酸银溶液并静置后,溶液颜色变浅
B.反应CO(g)+NO2(g)CO2(g)+NO(g)+Q,Q>0,平衡后,升高温度体系颜色变深
C.用饱和食盐水除去Cl2中的HCl
D.合成氨反应中,为提高原料的转化率,可采用高温加热的条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃的衍生物有多种,按要求回答下列问题:
(1)若分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不可能为________(填序号)。
A.醇 B.醛 C.羧酸 D.酚
(3)与![]() 具有相同官能团的同分异构体的结构简式为______________(写出一种即可)。
具有相同官能团的同分异构体的结构简式为______________(写出一种即可)。
(4)苯氧乙酸(![]() )有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________(写出任意两种的结构简式)。
)有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________(写出任意两种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电剧、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3, 含有SiO2、Fe2+、Mg2+等杂质)为原料制备氟化钡的流程如下:
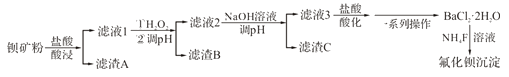
已知:常溫下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
(1)滤渣A的化学式为_________________。
(2)滤液1加H2O2氧化的过程中主要反应的离子方程式为__________________。
(3)加20%NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________。
(4)滤液3加入盐酸酸化后再经__________、冷却结晶、__________、洗涤、真空干燥等一系列操作后得到BaCl2·2H2O。
(5)常温下,用BaCl2·2H2O配制成0.2mol·L-1水溶液与等浓度的氟化铵溶液反应,可得到氯化钡沉淀。 已知Ksp(BaF2)=1.84×l0-7,当钡离子完全沉淀时(即钡离子浓度≤10-5mol·L-1),溶液中氟离子浓度至少是____________mol·L-1。(结果保留三位有效数字,已知![]() =1.36)
=1.36)
(6)已知:Ksp(BaCO3)=2.58×10-9,Ksp(BaSO4)=1.07×10-9。将氯化钡溶液滴入等物质的置浓度的硫酸钠和碳酸钠的混合溶液中,当BaCO3开始沉淀时,溶液中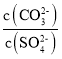 =___________(结果保留三位有效数字)。
=___________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() +CH3CHO+HBr
+CH3CHO+HBr![]()
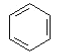
 +H2O(卤烷基化反应);
+H2O(卤烷基化反应);
![]() +
+![]()
![]()
![]() +NaX
+NaX
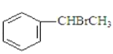
用苯为原料合成化合物Ⅳ的线路如下:
![]() I
I![]()
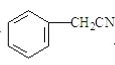
![]() II
II![]() III
III![]() IV(C15H14O2)
IV(C15H14O2)
其中:Ⅱ是羧酸。请回答下列问题:
(1)②的反应类型是________。
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种)_____、_____。
a.能与FeCl3溶液作用显紫色;
b.能发生银镜反应;
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为 1:2:1。
(3)1mol化合物Ⅳ完全燃烧消耗O2_____mol,化合物Ⅳ的结构简式是__________。
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com