
| A、1:1 | B、1:2 |
| C、2:3 | D、2:1 |
| ||
| ||
| 1 |
| 2 |
| ||
| ||
| ||
| 1 |
| 2 |
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持恒容恒温条件,向密闭容器中充入氦气,化学反应速率将变快 |
| B、若容器的容积不变,降低温度,c(CO2)/c(CO)减小 |
| C、保持恒容恒温(T1)条件,8min达化学平衡状态时,v(CO)=0.0625mol/(L?s) |
| D、保持恒容恒温(T1)条件,8min后再加入足量FeO粉末并充入1.5mol的CO气体,重新达到平衡时,CO的转化率为33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
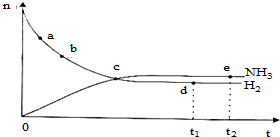 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、点c处用氨气的浓度表示的速率等于用氢气的浓度表示的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶刚用蒸馏水洗净,没有烘干 |
| B、没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 |
| C、定容时滴加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 |
| D、定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中加入稀硫酸再加入铜粉,共热,铜粉溶解且有红棕色气体产生,说明原溶液中含有NO3- |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成且能溶于浓硝酸 |
| C、某溶液中加入NaOH溶液,加热能产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中含有NH4+ |
| D、在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com