
| A、标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5×6.02×1023个 |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度 |
| D、同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11 |
| M |
| Vm |
| m |
| M |
| M |
| Vm |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol?L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 实验①和②探究 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是吸热反应 |
| B、是放热反应 |
| C、是熵减反应 |
| D、是熵增效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,等体积的CH4和CO2所含共用电子对数相等 |
| B、与NaOH溶液、H2SO4溶液反应产生等量H2,所需铝粉质量相等 |
| C、1 mol OH-和17 g NH3所含电子数相等 |
| D、明矾溶液中K+和Al3+物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| C、向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
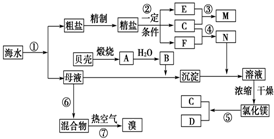
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com