
 如图是以石墨为电极电解CuCl2溶液的装置示意图.
如图是以石墨为电极电解CuCl2溶液的装置示意图.

科目:高中化学 来源: 题型:
| A、0.1 mol Fe与足量盐酸反应,转移的电子数为0.3NA |
| B、0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA |
| C、标况下,22.4L汽油的分子数为NA |
| D、常温常压下,36.5g HCl溶于水形成1L溶液,其物质的量浓度为1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
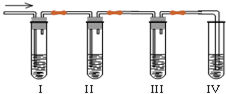 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
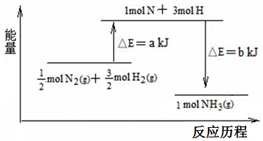 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图②所示实验装置排空气法收集H2气体 |
| C、图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 |
| D、图④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 | ||||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||
| C、将过量二氧化硫气体入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com