
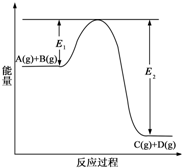
 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
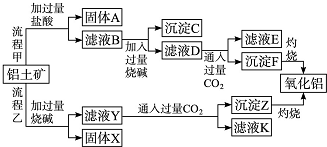
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、容器体积增加可以是向其中充入了惰性气体 |
| D、a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子化合物 | 离子电荷数 | 晶格能 kJ?mol-1 | 熔点 °C | 莫氏硬度 |
| NaF | 1 | 923 | 993 | 3.2 |
| NaCl | 1 | 786 | 801 | 2.5 |
| MgO | 2 | 3791 | 2852 | 6.5 |
| CaO | 2 | 3401 | 2614 | 4.5 |
| A、晶格能的大小与正负离子电荷数和距离成正比 |
| B、NaF晶体比NaCl晶体稳定 |
| C、表中物质CaO的晶体最稳定 |
| D、晶格能就是正负离子间的静电引力,晶格能越大,晶体的熔点越高,硬度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:
烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:查看答案和解析>>
科目:高中化学 来源: 题型:
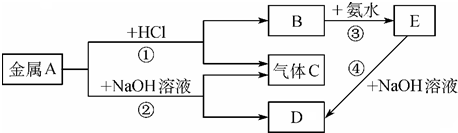
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+一定存在 |
| B、100ml溶液中含0.01molCO32- |
| C、Cl-一定存在 |
| D、Fe3+一定不存在,Mg2+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com