
【题目】锗是典型的半导体元素,在电子、材料等领域应用广泛。
(1)写出Ge原子结构示意图___。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是___。
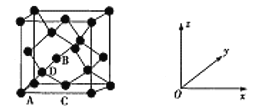
(3)Ge单晶具有金刚石型的结构,如图为晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ,0,
,0,![]() ),C为(
),C为(![]() ,
,![]() ,0),D原子的坐标参数为___;若晶胞参数为anm,NA表示阿伏伽德罗常数,则其晶胞密度为___g/cm3(列出计算式即可)。
,0),D原子的坐标参数为___;若晶胞参数为anm,NA表示阿伏伽德罗常数,则其晶胞密度为___g/cm3(列出计算式即可)。
【答案】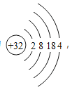 Ge原子半径大,原子之间形成的σ键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 (
Ge原子半径大,原子之间形成的σ键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 (![]() ,
,![]() ,
,![]() )
) ![]() ×107
×107
【解析】
(1)Ge是32号元素,位于第四周期第IVA族;
(2)虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge的原子半径大,原子间形成的σ单键较长,p-p轨道难以通过“肩并肩”方式形成π键;
(3)对照晶胞图示,坐标系以及A、B、C点坐标,选A点为参照点,观察D点在晶胞中位置,即体对角线的![]() ,运用均摊法计算可得。
,运用均摊法计算可得。
(1)Ge是32号元素,位于元素周期表第四周期IVA族,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge的原子半径大,原子间形成的σ单键较长,p-p轨道难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或叁键,故答案为:Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;
(3)对照晶胞图示,坐标系以及A、B、C点坐标,选A点为参照点,观察D点在晶胞中位置,即体对角线的![]() ,D的坐标参数为(
,D的坐标参数为(![]() ,
,![]() ,
,![]() );类似金刚石晶胞,1个晶胞含有8个锗原子,即晶胞的质量为
);类似金刚石晶胞,1个晶胞含有8个锗原子,即晶胞的质量为![]() ,晶胞的体积为(a×10-10)3cm3,即晶胞的密度为
,晶胞的体积为(a×10-10)3cm3,即晶胞的密度为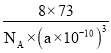 g/cm3=
g/cm3=![]() ×107 g/cm3,故答案为:(
×107 g/cm3,故答案为:(![]() ,
,![]() ,
,![]() );
);![]() ×107。
×107。


科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”(IYPT2019)。我国华东师范大学80后科学家姜雪峰教授被遴选为硫元素的代言人。其课题组运用“从无机硫向有机硫”转化的理念,构建起了“3S绿色硫化学”。下列有关S的说法正确的是( )
A.位于元素周期表中第三周期第VA族
B.硫元素原子结构示意图: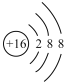
C.![]() S原子的中子数是32
S原子的中子数是32
D.有机化合物中可能含有硫元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O―→
H2O―→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O![]() Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________。
(2)上述反应①中氧化剂为______,被氧化的物质是______。若有2 mol Na2FeO2生成,则反应①中有________mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________(填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体准晶体和非晶体。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为___。
(3)NH4F(氟化铵)可用于玻璃的蚀刻、防腐剂、消毒剂。氟化铵溶液中存在__(填字母)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____kJmol-1。
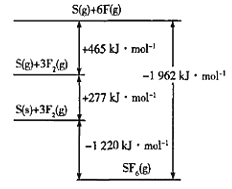
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性如图甲可通过观察_____________,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论__________(填“合理”或“不合理”),理由是___________
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_____________________。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
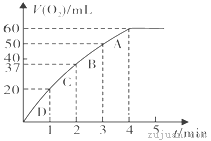
①实验时放出气体的总体积是__________mL。
②放出1/3气体所需时间为___________min。
③计算H2O2的初始物质的量浓度_______________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
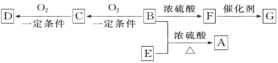
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,推出图中标记的11种元素,回答下列问题:
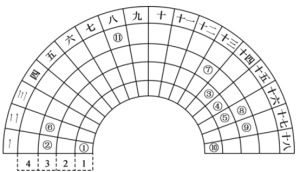
(1)⑤的简单阴离子的结构示意图为_______,的原子序数为___________。
(2)④的简单氢化物的电子式为__________________。
(3)在11种元素中,单质的化学性质最不活泼的是__________(填化学式)。
(4)⑧、⑨两种元素形成的最高价氧化物的水化物中,酸性较强的是_______(填化学式)。
(5)加热时,③的单质能和⑧的最高价氧化物的水化物的浓溶液发生反应,化学方程式为___________。
(6)⑦在元素周期表中的位置是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,回答下列问题
I.氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应均为2H2+O2 = 2H2O。
(1)工作时,电解质溶液中的阴离子移向_______极(填“正”或“负”)。
(2)酸式氢氧燃料电池的电解质溶液是稀硫酸,其正极的电极反应为________。
(3)碱式氢氧燃料电池的电解质溶液是KOH溶液,其负极的电极反应为_______。
II.通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,O2-可在固体电解质中自由移动。
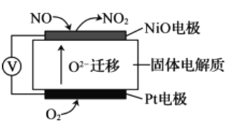
(1)NiO电极上发生的是________反应(填“氧化”或“还原”)。
(2)外电路中,电子是从_________电极流出(填“NiO”或“Pt”)。
(3)Pt电极的电极反应为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com