
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
H-H | N-H | N-N | N≡N |
435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。

【答案】 -92.5kJ/mol(1分) 不变 减小 p1>p2>p3 该反应的正反应为气体体积减小的反应,相同温度下,增大压强平衡正移,NH3 的体积分数增大,由图可知p1>p2>p3 5.93×103 (mol/L)-2 或 5925.93(mol/L)-2 ①② N2+6e-+6H+=2NH3 3H2-6e-=6H+ 9.33L
【解析】⑴△H=E断-E成=945.8+3×435.5-6×390.8=-92.5 kJ/mol ⑵在恒温恒压条件下通NH3相当于平衡不移动,所以不变;恒温恒容条件下相当于加压,平衡正移,比值减小;⑶该反应的正反应为气体体积减小的反应,增大压强平衡正移。NH3 的体积分数增大,由图可知p1>p2>p3。 由图可知氨气的体积分数为0.667,根据三段式可计算出c(NH3)=0.16mol/L c(N2)=0.02mol/L c(H2)=0.06mol/L,则K=5925.93; ⑷①相当于正逆速率相等,能说明该反应达到平衡状态;②气体密度会随平衡的移动而变化,不变时说明达平衡,能说明该反应达到平衡状态;③④⑤中的量永远为定值,不能说明该反应达到平衡状态;答案选①②; ⑸正极:N2+6e-+6H+=2NH3 负极:3H2-6e-=6H+ 整个计算用电子守恒,通过2molH+时则有1/3molN2参与反应,相当于(1/3)×(5/4)×22.4=9.33L空气。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明
显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
![]()
![]()
![]()
![]()
![]()
则操作①的名称为________,试剂A的化学式为________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________(填化学式),产生该白色沉淀的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)B为__________(填写元素符号),D的最高价氧化物对应的水化物是_________(填写化学式),离子半径大小B_________C(填“>”“<”或“=”);
(2)写出A、B的化合物与E反应的化学方程式:______________________;A、B两元素形成的化合物属于_________(填“离子”或“共价”)化合物。
(3)A的单质与D的最高价氧化物对应的水化物反应的化学方程式为_______________。
Ⅱ.常温下由三种短周期元素形成的气体单质X、Y、Z,有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(4)化合物甲的电子式是_____________;化合物丙中存在的化学键为___________、_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出C1O2,C1O2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量C1O2,充分反应。
(1)仪器a的名称为_______,仪器b的作用是_____。
(2)装置A中生成NaC1O2的离子方程式为_______。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶______、_____干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(5)B中现象为_________ 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
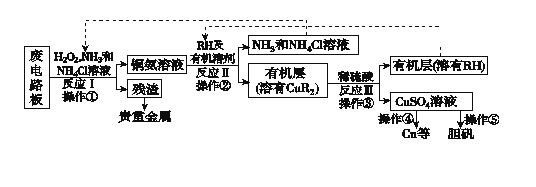
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是____________。写出操作①的名称:________。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式:__________________________________________。操作②用到的主要仪器名称为______________,其目的是(填序号)________。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和________。若操作③使用如图装置,图中存在的错误是__________________________________________。
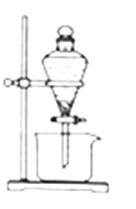
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是________________。 流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。下列有关说法正确的是
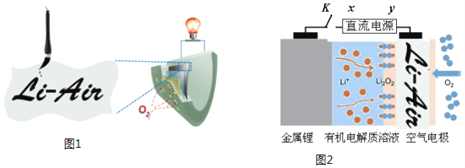
A. 放电时,纸张中的纤维素作锂电池的正极
B. 开关K闭合给锂电池充电,X为直流电源负极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为:Li2O2+2e-=O2↑+2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断锌是( )
A. 负极,被氧化B. 正极,被还原
C. 负极,被还原D. 正极,被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com