
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
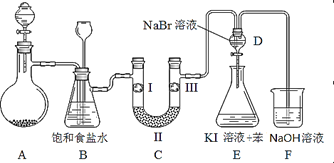
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2中混有的HCl B中长颈漏斗中有水柱上升 d 橙 氯单质的氧化性比溴强 液体分为两层,上层液体显紫红色 Cl2 + 2NaBr=2NaCl + Br2、Br2 + 2KI=2KBr+ I2 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 除去Cl2中混有的HCl B中长颈漏斗中有水柱上升 d 橙 氯单质的氧化性比溴强 液体分为两层,上层液体显紫红色 Cl2 + 2NaBr=2NaCl + Br2、Br2 + 2KI=2KBr+ I2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;制取的氯气中含有氯化氢杂质,结合装置中气体压强变化分析现象;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中氯气和水反应生成次氯酸具有漂白性;
(3)氯气的氧化性强于溴,溴的氧化性强于碘,据此分析解答;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水。
(1)二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;制取的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择饱和食盐水吸收氯气中的氯化氢,装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中气体的压强增大,B中长颈漏斗中液面上升,形成水柱,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;制取的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择饱和食盐水吸收氯气中的氯化氢,装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中气体的压强增大,B中长颈漏斗中液面上升,形成水柱,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl;B中长颈漏斗中有水柱上升;
MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl;B中长颈漏斗中有水柱上升;
(2)装置C的实验目的是验证氯气是否具有漂白性,实验事实是干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性。选项中的Ⅱ都是干燥剂,要验证氯气不具有漂白性,需要干燥的氯气和干燥的有色布条,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱,因此D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,Cl2 + 2NaBr=2NaCl + Br2,可以看到无色溶液逐渐变为橙色,打开活塞,将装置D中少量溶液加入装置E中,溴将KI溶液中的碘置换出来,Br2 + 2KI=2KBr+ I2,溶液从无色变化为黄色,碘易溶于苯,苯不溶于水,振荡,苯层呈现紫红色,故答案为:橙;氯单质的氧化性比溴强;液体分为两层,上层液体显紫红色;Cl2 + 2NaBr=2NaCl + Br2、Br2 + 2KI=2KBr+ I2;
(4)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以被氢氧化钠吸收,反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4(s)受热分解制备氧气是实验室制氧气的常用方法,它也是一种高效氧化剂,是氧化还原滴定实验中常用的试剂,可以作为标准溶液滴定一些具有还原性的物质(Fe2+、C2O42-等)的溶液,如5C2O42-+2MnO4-+l6H++4H2O=2[Mn(H2O)6]2++10CO2↑。
(1)基态Mn2+的核外电排布式为___。
(2)如果在空气中焙烧KMnO4,可获得Mn3O4(可改写为MnOMn2O3),则Mn3O4中Mn的化合价为___。
(3)石墨烯(如图A)是一种由碳原子组成六边形呈蜂巢晶格的二维碳纳米材料,当石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图B)。
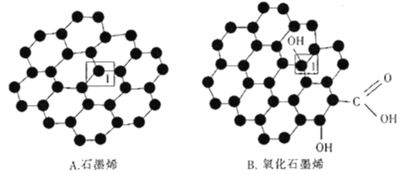
石墨烯结构中1号C的杂化方式为___;该C与相邻的两个C形成的键角___(填“>”“<”“=”)l20。氧化石墨烯结构中1号C与相邻C___(填“有”或“没有”)形成π键。
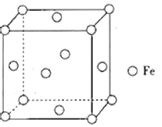
(4)铁形成的晶体类型因为铁原子排列方式的不同而不同,其中一种晶胞结构如图所示。晶体中铁原子周围距离最近且等距的铁原子数为___。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该物质的化学式为___;设NA为阿伏加德罗常数的值,该铁碳晶胞的晶胞参数为apm,则C原子间的最短距离为______pm,该铁碳晶胞的密度为___ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是

A.该有机物易溶于水
B.可以与Na2CO3生成2molCO2
C.该分子对称性好,所以没有顺反异构
D.该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从海带中提取碘的工业生产过程,有关说法错误的是()
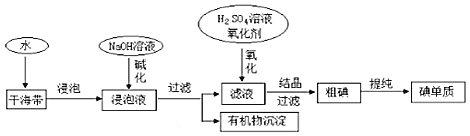
A.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
B.含NA个Na+的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1mol·L-1
C.在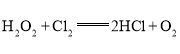 反应中,每生成32g氧气,则转移2NA个电子
反应中,每生成32g氧气,则转移2NA个电子
D.常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含![]() 物质的量相同
物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属钠和镁,请根据下列工艺生产流程回答问题。

(1)海水提取镁要用到海滩上的贝壳,贝壳煅烧过程中发生反应的化学方程式为___。
(2)母液中加入石灰乳反应的离子方程式为__。
(3)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,而MgO的熔沸点非常高,达到熔融状态需要消耗很多能源。所以,用电解法制取金属镁时,需要无水氯化镁。写出用电解法制取金属镁的化学方程式___。
(4)在以上提取镁的过程中,没有涉及的化学反应类型是__。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池原理如图所示,下列说法正确的是( )
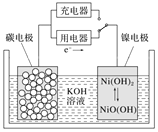
A.放电时,OH-移向镍电极
B.放电时,负极的电极反应为H2-2e-+2OH-=2H2O
C.充电时,将电池的碳电极与外电源的正极相连
D.充电时,阴极附近的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com