
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有漂白性 |
| B | Cl2能使湿润的红色布条褪色 | 证明Cl2具有漂白性 |
| C | 蓝矾固体放在浓硫酸中充分振荡,固体变为白色 | 证明浓硫酸具有吸水性 |
| D | 向某待测溶液中,加入BaCl2溶液,产生白色沉淀,然后再继续加入稀盐酸,沉淀不消失. | 证明待测溶液中含有SO42- |
| A、A | B、B | C、C | D、D |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
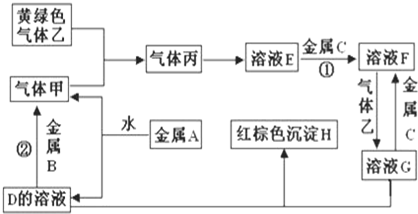
 观察图,回答问题.
观察图,回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加氨水的过程中,水的电离平衡将正向移动 |
| B、滴加b L氨水后的溶液中,n(NH4+)=200 n(NH3?H2O)=1mol |
| C、所滴加氨水的浓度为0.005/b mol?L-1 |
| D、滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+)=c(NO3-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2的转化率提高 |
| B、颜色变浅 |
| C、压强为原来的两倍 |
| D、平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.4g | B、11.6g |
| C、8.8g | D、3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5mol/L |
| B、2.0mol/L |
| C、0.18mol/L |
| D、0.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素B、E组成的化合物BE4常温下呈气态 |
| B、一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
| C、C、D、E的半径:C>D>E |
| D、化合物AE与CE是同类化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com