
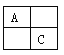
【题目】(14分)A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
(1)D的离子结构示意图为_____________。
(2)B、C、D形成的简单离子半径由大到小的顺序: > > (写离子符号)
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到60 mL 10.0 mol/L乙的浓溶液中,充分反应,共收集到4.48L(标准状况)气体,则该气体的成分是_________,反应中电子转移数为____________。若使上述中反应后剩余的铜片继续溶解,可向其中加入稀硫酸,写出反应的离子方程式: 。
(4)将两份足量的B单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________。
【答案】(共14分)
(1) (2分)
(2分)
(2)S2-> Cl->Al3+ (2分)
(3)NO2 NO (2分 多写少些均不得分 )
0.4 mol(2分) 3Cu+8H++2NO3-=3Cu2++2NO +4H2O(2分)
(4) 2:3(2分) Al3++3[Al(OH)4 ] -="4" Al(OH)3(2分)
【解析】试题分析:A元素最外层与次外层上的电子数之差为3,根据A在元素周期表中的位置,可知A为N元素,则C为S元素,A、B、C、D是原子序数依次增大的短周期主族元素,则D为Cl元素,因为B为地壳中含最最多的金属元素,则B为Al元素。
(1)D为Cl元素,则D离子为Cl,结构示意图为:
(2)B、C、D形成的简单离子分别为Al3+、S2、Cl,根据电子层数越大,离子半径越大;电子排布相同的离子,原子序数越大,离子半径越小,所以B、C、D形成的简单离子半径由大到小的顺序为:S2-> Cl->Al3+
(3)A的最高价氧化物对应的水化物是HNO3,因为Cu过量,随着反应的进行,HNO3的物质的量逐渐减少,浓硝酸变为稀硝酸,所以生成的气体为NO2和NO;HNO3物质的量为0.06L×10.0 molL1=0.6mol,生成的的气体在标准状况下的体积为4.48L,则物质的量为0.2mol,因为Cu过量,HNO3完全反应,起酸性作用的硝酸物质的量为:0.6mol-0.2mol=0.4mol,根据Cu(NO3)2的组成可知反应的Cu物质的量为0.2mol,根据Cu化合价的变化可知电子转移数为0.4 mol;加入稀硫酸后,NO3、H+可以继续与Cu反应,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO +4H2O。
(4)Al与硫酸反应的化学方程式为:2Al+3H2SO4=2Al2(SO4)3+3H2↑,Al与NaOH溶液反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑因为H2SO4与NaOH物质的量相等,所以生成气体的体积比为:2:3;将反应后所得的溶液混合,Al3+与[Al(OH)4]发生水解反应,会生成白色沉淀Al(OH)3,所以发生反应的离子方程式为: Al3++3[Al(OH)4 ] -="4" Al(OH)3


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1 mo1X能与足量碳酸氢钠溶液反应放出44.8 LCO2(标准状况),则X的分子式是( )
A. C5H10O4B. C4H8O4C. C3H6O4D. C2H2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
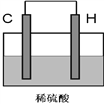
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年9月,美国科学家宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现,有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上面所述中“结合力”的实质是( )
A.分子间作用力 B.氢键 C.非极性共价键 D.极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A. 用铜电极电解NaCl溶液制备Cl2:2C1—+2H2O![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
B. 向MgCl2溶液中加入氨水制备Mg(OH)2:Mg2++2OH—==Mg(OH)2↓
C. 将FeS溶于稀硝酸制备Fe(NO3)3:FeS+4H++NO3==Fe3++NO↑+S↓+2H2O
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2==2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A化学式为CxHyOz , 15 g A完全燃烧可生成22 g CO2和9 g H2O。试求:
(1)该有机物的最简式______________;
(2)若A的相对分子质量为60,且A和Na2CO3溶液反应有气体放出,A和醇能发生酯化反应, 则A的结构简式为_________________;
(3)若A的相对分子质量为60,且A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0.
Fe(s)+CO2(g)△H>0.
已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值________(填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向__________进行(填“左”或“右”).
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.

①反应开始至平衡,氢气的平均反应速率v(H2)=__________,CO2的转化率为_______.
该温度下上述反应的平衡常数K=____________(分数表示).
②反应达到平衡后,下列能使![]() 的值增大的措施是_________(填符号)。
的值增大的措施是_________(填符号)。
a.升高温度 b.再充入H2 c.再充入CO2
d.将H2O(g)从体系中分离 e.充入He(g)
③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:_________________。
④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com