
【题目】某有机物A化学式为CxHyOz , 15 g A完全燃烧可生成22 g CO2和9 g H2O。试求:
(1)该有机物的最简式______________;
(2)若A的相对分子质量为60,且A和Na2CO3溶液反应有气体放出,A和醇能发生酯化反应, 则A的结构简式为_________________;
(3)若A的相对分子质量为60,且A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为_______________________。
【答案】 CH2O CH3COOH HCOOCH3
【解析】(1)n(CO2)= ![]() =0.5mol,则n(C)=0.5mol,m(C)=0.5mol×12g/mol=6g,n(H2O)=
=0.5mol,则n(C)=0.5mol,m(C)=0.5mol×12g/mol=6g,n(H2O)= ![]() =0.5mol,则n(H)=1mol,m(H)=1mol×1g/mol=1g,根据质量守恒可知,A中m(O)=15g-6g-1g=8g,则n(O)=
=0.5mol,则n(H)=1mol,m(H)=1mol×1g/mol=1g,根据质量守恒可知,A中m(O)=15g-6g-1g=8g,则n(O)= ![]() =0.5mol,故n(C):n(H):n(O)=0.5mol:1mol:0.5mol=1:2:1,故A的实验式为CH2O,故答案为:CH2O;
=0.5mol,故n(C):n(H):n(O)=0.5mol:1mol:0.5mol=1:2:1,故A的实验式为CH2O,故答案为:CH2O;
(2)若A的相对分子质量为60,A和Na2CO3混合有气体放出,和醇能发生酯化反应,说明A中含有-COOH,且A的实验式为CH2O,则A为乙酸,其结构简式为:CH3COOH,故答案为:CH3COOH;
(3)若A是易挥发、有水果香味的液体,能发生水解反应,说明A中含有酯基,属于酯,且A的实验式为CH2O,则A为甲酸甲酯,其结构简式为:HCOOCH3,故答案为:HCOOCH3。


科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是
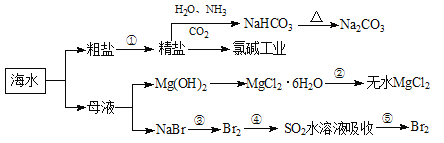
A.第①步中除去粗盐中的SO![]() 、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.制取NaHCO3的反应是利用其溶解度小于NaCl
C.从第③④⑤步的目的是浓缩、富集溴单质,这三步中溴元素均被氧化
D.过程②中结晶出的MgCl2·6H20可在空气中受热脱水制得无水MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
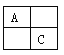
(1)D的离子结构示意图为_____________。
(2)B、C、D形成的简单离子半径由大到小的顺序: > > (写离子符号)
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到60 mL 10.0 mol/L乙的浓溶液中,充分反应,共收集到4.48L(标准状况)气体,则该气体的成分是_________,反应中电子转移数为____________。若使上述中反应后剩余的铜片继续溶解,可向其中加入稀硫酸,写出反应的离子方程式: 。
(4)将两份足量的B单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B. H2的热值为142.9kJ/g,则有2H2 (g)+O2(g)=2H2O (l) △H=-285.8kJ/mol
C. 将浓度为0.1mol/LHF溶液加水不断稀释过程中,  始终保持减小
始终保持减小
D. 混合前![]() ,等体积的混合后溶液中:
,等体积的混合后溶液中: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸酸化可以制备草酸(H2C2O4),装置如图所示:
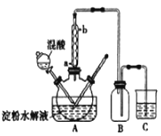
实验过程如下:
①将1:1的淀粉水乳液与少许98%硫酸加入烧杯中,水浴加热30 min;
②将一定量的淀粉水解液加入三颈烧瓶中;
③在5560℃条件下,缓慢滴加混酸(65%HNO3与98%H2S04的质量比为4 : 3)溶液;
④反应3h左右,冷却、过滤后再重结晶得二水合草酸晶体(H2C2O4·2H2O)。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9 H2O
C6H12O6+8HNO3=6CO2↑+8NO↑+10H2O
C6H12O6+2HNO3=6CO2↑+2NO↑+4H2O
请回答下列问题:
(1)实硷①加入98%硫酸少许的目的是_____________。
(2)检验淀粉是否水解完全所用的试剂为____________。
(3)冷凝水的进口是_______(填“a”或“b”)。
(4)装置B的作用为___________。
(5)实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________。
(6)当尾气中n(NO2) :n(NO)=1:1时,过量的NaOH溶液能将氮氧化物全部吸收,只生成一种钠盐,化学方程式为__________。若用步驟④后含硫酸的母液来吸牧氮氧化物,其优点是_____,缺点是________。
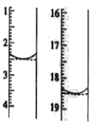
(7)二水合草酸晶体纯度的测定。称取该晶体0.12g,加水溶解,用0.020 mol L-1的酸性KMnO4溶液滴定(杂质不参与反应),该反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O。此时溶液颜色由_____变为_____。滴定前后液面读数如图所示,则该晶体中二水合草酸的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组原子中,彼此的化学性质一定相似的是 ( )
A. P原子:1s2;Q原子:2s2
B. P原子:M能层上有2个电子;Q原子:N能层上有2个电子
C. P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子
D. P原子:最外层L能层上只有一个空轨道;Q原子:最外层M能层上也只有一个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。某兴趣小组的实验数值结果大于57.3 kJ·mol-1(中和热),原因可能是

A. 实验装置中小烧杯杯中低于大烧杯杯口
B. 用浓硫酸代替了稀硫酸
C. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D. 用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com