
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 相关实验 | 预期目的 | |
| A | 相同温度下,等质量的大理石块、大理石粉分别与等湾积、等浓度的盐酸反应 | 探究接触面积对化学反应速率的影响 |
| B | 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 | 探究蔗糖水解产物具有还原性 |
| D | 两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应 | 断键 | 对应的化学方程式 |
| 乙醇和钠的反应 | ||
| 乙醇和乙酸浓硫酸共热 | ||
| 在银催化下和氧气作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(HCO3-) |
| c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
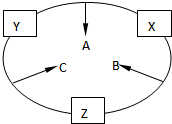 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D溶液的PH=7 |
| B、四种溶液相比,C溶液中水的电离程度最大 |
| C、A与C等体积混合,溶液中有c(C1-)>c(NH4+)>c(H+)>c(OH-) |
| D、B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
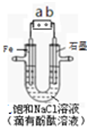 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com