
����Ŀ����Ԫ�ؿ����γ������������������������й㷺��Ӧ�á�
��1����NF3���ӻ�Ϊ�ȵ�����ķ���Ϊ________��
��2�����Ͱ�����640��ɷ����û���Ӧ������֮һ�ľ����ṹ��ͼ�ס�
д��Fe3+�Ļ�̬�����Ų�ʽ________��
д���÷�Ӧ�Ļ�ѧ����ʽ��______________��

��3��ά����B4�ṹ��ͼ�ң���1molά����B4�����к��ЦҼ�����ĿΪ______mol��
��4���������Ľṹ��ͼ�����к���__________������ţ���
a�����Թ��ۼ� b���Ǽ��Թ��ۼ� c����λ�� d�����
����̼ԭ�ӵ��ӻ���ʽ��______________��
���𰸡� NCl3��ClO2 �� [Ar]3d5 8Fe+2NH3 ![]() 2Fe4N+3H2 16 a b c d sp2��sp3
2Fe4N+3H2 16 a b c d sp2��sp3
����������1���ȵ�����Ϊԭ����������Ҽ۵���������ȣ�����NF3���ӻ�Ϊ�ȵ�����ķ���ΪNCl3��ClO2 �ȣ�
2��Fe�ĺ˵����Ϊ26�����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]3d64s2����Fe3+�Ļ�̬�����Ų�ʽ[Ar]3d5���þ�������ԭ�Ӹ���=8��![]() +6��
+6��![]() =4����ԭ�Ӹ�����1�����Ե������Ļ�ѧʽ��Fe4N�����Ͱ�����640��ɷ����û���Ӧ���ɵ����͵����������Ը÷�Ӧ����ʽΪ��8Fe+2NH3
=4����ԭ�Ӹ�����1�����Ե������Ļ�ѧʽ��Fe4N�����Ͱ�����640��ɷ����û���Ӧ���ɵ����͵����������Ը÷�Ӧ����ʽΪ��8Fe+2NH3![]() 2Fe4N+3H2��
2Fe4N+3H2��
��3�����ӽṹ�е���ȫ��Ϊ������˫���а���һ�������������ά����B4�ṹ��֪ÿ��B4�����к���16����������1molά����B4�����к�����������ĿΪ16mol��
��4������ͼ��֪̼̼���γɷǼ��Թ��ۼ���̼����Ϊ���Թ��ۼ���������Ϊ��λ����������γ��������ѡabcd��̼̼���γɵ�����Ϊsp3�ӻ����е�̼̼���γ�˫����Ϊsp2�ӻ���


 ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����������ȼ�ϵ�صĹ���ԭ����ͼ��ʾ,�õ�ط�ӦΪMg+ClO-+H2O��Mg(OH)2+Cl-�����й�˵����ȷ����

A. ��ع���ʱ,c��Һ�е�������MgCl2
B. ��ع���ʱ,����a������pH����������
C. ������Ӧʽ:ClO--2e-+H2O��Cl-+2OH-
D. b�缫������ԭ��Ӧ,ÿת��0.1 mol����,����������0.1 mol Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������X�����Y���壬�������·�Ӧ��X(g)��2Y(g) ![]() Z(g)��Ӧ�����вⶨ�IJ������ݼ��±���
Z(g)��Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
����˵����ȷ����
A. ǰ10 min�ڷ�Ӧ��ƽ������Ϊv(Z)��0.10 mol��L��1��min��1
B. �¶�Ϊ200��ʱ��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ
C. ���ܱ���������ɱ䣬�����������䣬�ڴﵽƽ�����С�������Ϊԭ��һ�룬��c(X)��1mol/L
D. ���������������䣬���������ٳ���1.00 mol X�����1.20 mol Y���壬����ƽ���Xת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�ء�
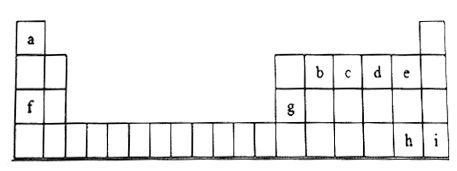
���ݱ���������Ϣ���ش��������⣺
(1)cԪ��ԭ�ӵ�����������Ӧ��ˮ����Ļ�ѧʽ___________(�ѧʽ)
(2)b��c��d��e��ԭ�Ӱ뾶����_______(�����С��)
(3)e��hԪ��ԭ���γɵ��⻯���У����ȶ��Դ����__________(���⻯��Ļ�ѧʽ)
(4)f��gԪ�ص�����������Ӧˮ����֮�䷢����Ӧ�Ļ�ѧ����ʽ__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��������Ԫ����ɵĻ�������д��ԣ�ij�о�С�鰴��ͼ����̽������ɣ�

�ش�����������
(1)���A������Ԫ�طֱ�Ϊ_______��_____(��Ԫ�ط��ţ���ʵ����������Aʱ��ʢװA����������Ϊ_____________��
(2)A�ɱ�������ԭΪ�������ʣ�ͬʱ���ɡ�����̬�⻯��X��X���ܶ�����ͬ�����������ܶȵ�17����X�ĵ���ʽΪ_______________��
(3)������ɫ����Eͨ���ɫ��ҺC�У���Һ���ձ��dz��ɫ����Ӧ�����ӷ���ʽΪ________________��
��ɫ������ҺF����ˮ��Ӧ�Ļ�ѧ����ʽΪ_____________��
(4)ȡ��ɫ��ҺG�����BaCl2��Һ��Ӧ���ϲ���Һ����һ֧�Թ��У��μ�H2O2��Һ����������ɫ������˵��G��Һ�к���____________(�ѧʽ)��
(5)��ȡ5.920g A�ڿ����г�����գ�����4.800g����ɫ����B���ɼ�����֪A�Ļ�ѧʽΪ____________��A����ϡ���ᷴӦ������һ�ֵ���ɫ���������̬�⻯��X����Ӧ�����ӷ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ԫ�ص����ʼ���ݱ������ȷ����(����)
A. �ڶ�����Ԫ�ش����ң�������۴�+1������+7
B. ͬһ�����Ԫ�أ�ԭ�Ӱ뾶Խ��Խ����ʧȥ���ӣ��䵥�ʵ�������Խǿ
C. �����������ȴ������������Ԫ��һ��λ�ڵڶ�����
D. �����Ԫ����ָ��A�������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬��A��B��ɵĻ��������ȫȼ�պ�õ�CO2��H2O(g)�����ʵ����������������ʵ����ı仯��ͼ��ʾ��������˵����ȷ���ǣ� ��

A. �������һ����������ϩ B. �������n(C)��n(H)=2��5
C. �������ΪCH4��C3H4���������Ϊ3��7 D. �������ΪCH4��C4H4���������Ϊ4��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ֽ������ܶ�������Ӱ�졣ʵ����70��ʱ��ͬ������H2O2Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ͼ�ױ���,����������ͬʱ��H2O2Ũ��ԽС,��ֽ�����Խ��
B. ͼ�ұ���,����������ͬʱ����ҺPH ԽС��H2O2�ֽ�����Խ��
C. ͼ������,����Mn2+����ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D. ͼ����ͼ��������������Һ�У�Mn2+��H2O2�ֽ����ʵ�Ӱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2(g)������ӦH2(g)+Br2(g)![]() 2HBr(g)����H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ����
2HBr(g)����H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ����

A����b��c�����ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2
B��a��b����ķ�Ӧ���ʣ�b��a
C��Ϊ�����Br2(g)��ת���ʿɲ�ȡ����Br2(g)ͨ�����ķ���
D��b��c�����HBr���������b��c
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com