
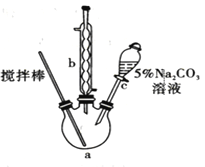
【题目】丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:
制取的反应原理:CH2 =CHCOOH + HOCH3![]() CH2=CHCOOCH3 + H2O。
CH2=CHCOOCH3 + H2O。
可能用到的信息如下表:
沸点 | 溶解性 | 性质 | |
丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(一)制取丙烯酸甲酯
①取0.14mol丙烯酸、0.2mol的甲醇、少量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,加热。
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性。
③分液,取上层油状液体,再加无水Na2SO4后,蒸馏,收集馏分。
(二)检验丙烯酸甲酯的产率,设计如下实验:
①将收集的油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00 mL,加热使之完全水解。
②用酚酞作指示剂,向冷却后的溶液中滴加0.5 mol·L-1的盐酸,滴定到终点时共消耗盐酸20.00 mL。
回答下列问题:
(1)仪器b的名称是_________________。
(2) 浓硫酸的作用_________________。
(3) 搅拌棒的作用:___________ ; 5% Na2CO3溶液的作用:______________。
(4) 加无水Na2SO4的作用:_____________ ;蒸馏收集___________温度的馏分。
(5) 滴定终点的判断:_________________________________________________。
(6)计算本次酯化反应中丙烯酸的转化率为____________(计算结果保留到小数点后一位)。
【答案】 冷凝管(或球形冷凝管) 催化剂 混合均匀,加快反应速率_ 除去浓硫酸、丙烯酸等酸 干燥剂(除去有机层中的水) 80.5℃ 当最后一滴HCl溶液滴入锥形瓶时,溶液由粉红色变成无色,且30s内不变色 53.6%
【解析】本题考查有机物的实验室制备,实验原理是酸与醇的酯化反应,属于可逆反应,为了提高产物的产率及提搞反应物的转化率,实验中采取了搅拌、将挥发出的反应物及时冷却回流等措施。
(1)仪器b的名称是冷凝管
(2)浓硫酸做催化剂,起催化的作用。
(3)搅拌棒的作用是:使反应物均匀混合,加快反应速率;碳酸钠可与硫酸、丙烯酸发生化学反应而除去,其作用是:除去浓硫酸、丙烯酸等酸
(4)Na2SO4固体可以吸水生成结晶水化物从而除去有机层中的水,Na2SO4的作用是:干燥剂(除去有机层中的水);丙烯酸甲酯的沸点为80.5℃,故应蒸馏收集80.5℃温度的馏分。
(5)丙烯酸甲酯在KOH的条件下发生彻底的水解反应,多余的KOH用HCl溶液中和滴定,用酚酞作指示剂,当滴入最后一滴盐酸时,溶液的颜色由红色变为无色,且30s内不恢复。答案为:当最后一滴HCl溶液滴入锥形瓶时,溶液由粉红色变成无色,且30s内不变色 。
(6) 0.14mol丙烯酸、0.2mol的甲醇理论上可以生成0.14mol丙烯酸甲酯;实验中:每份丙烯酸甲酯水解消耗的KOH的物质的量为(2.5×10-0.5×20)×10-3mol=0.015mol,丙烯酸甲酯与KOH按照物质的量之比1:1反应,所以总的丙烯酸甲酯的物质的量为0.015×5mol=0.075mol,所以产率为:0.075/0.14×100%=53.6%


科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中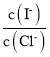 为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为___。若起始时n(HI)=100mol,则过程中需吸收的能量为___kJ。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为___(填字母)
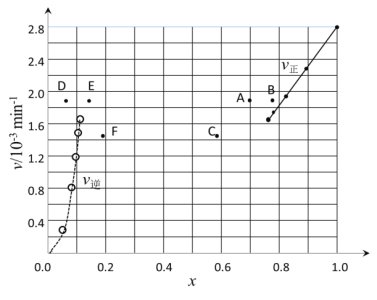
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
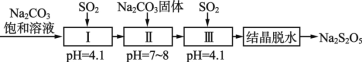
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Na2FeO4是一种离效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2Fe + 6Na2O2 = 2Na2FeO4 + 2 ![]() + O2↑。下列对此反应的说法中,不正确的是
+ O2↑。下列对此反应的说法中,不正确的是
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2molFeSO4发生反应时,反应中共转移8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料后,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化Fe2+![]() Fe3+,A反应中Fe2+作__剂,B反应中Fe3+作__剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__性。
Fe3+,A反应中Fe2+作__剂,B反应中Fe3+作__剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__性。
(2)新配制的FeCl2溶液应加入__以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的__。
(3)为除去废水中的Fe2+,常先将废水中的Fe2+氧化为__(用离子符号表示),再__使Fe3+转化为红褐色的__(用化学式表示)沉淀析出。
(4)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为__。
(5)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为__,__;处理过程中需定期添加的原料是__。
(6)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:取少许未知试液于试管中![]()
![]() 溶液呈红色(证明含有FeCl2),你认为此方案__(填“合理”或“不合理”),若不合理,如何改进:__。
溶液呈红色(证明含有FeCl2),你认为此方案__(填“合理”或“不合理”),若不合理,如何改进:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com