
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
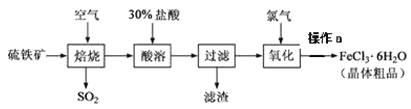
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2![]() 2SO3,该反应的平衡常数表达式为K=____;过量的SO2与NaOH溶液反应的化学方程式为_________________。
2SO3,该反应的平衡常数表达式为K=____;过量的SO2与NaOH溶液反应的化学方程式为_________________。
(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是 (___)
A.玻璃棒 B.烧杯 C.托盘天平 D.500mL量筒 E、500mL容量瓶 F、胶头滴管
(3)酸溶及后续过程中均需保持盐酸过量,其目的是________________________、
________________________________________________________。
(4)通氯气氧化时,发生的主要反应的离子方程式为_________________________;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为________________(写化学式)。
(5)操作a为_________________________、过滤、洗涤、干燥。
【答案】K=c2(SO3)/c(O2)·c2(SO2) SO2+NaOH=NaHSO3 ABDEF 提高铁元素的浸出率 抑制Fe3+水解 Cl2+2Fe2+=2Cl-+2Fe3+ Cl2、HCl 蒸发浓缩、冷却结晶
【解析】
根据流程可知,硫铁矿在高温下焙烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,最后得到的氯化铁溶液蒸发浓缩、冷却结晶后得到氯化铁晶体,据此分析作答。
(1)根据平衡常数的定义易知,该反应的化学平衡常数K=c2(SO3)/c(O2)·c2(SO2);过量的二氧化硫与氢氧化钠反应会生成亚硫酸氢钠,其化学方程式为:SO2+NaOH=NaHSO3;
(2)根据溶液配制的步骤分析可知,计算:结合c=![]() 可知,该浓盐酸的物质的量浓度为
可知,该浓盐酸的物质的量浓度为![]() mol/L=12mol/L,稀盐酸的物质的量浓度为
mol/L=12mol/L,稀盐酸的物质的量浓度为![]() =10.95mol/L,依据C浓V浓 = C稀V稀求出所需盐酸溶液的体积V浓=
=10.95mol/L,依据C浓V浓 = C稀V稀求出所需盐酸溶液的体积V浓=![]() =0.456L=456mL;量取:依据计算的体积,用500mL量筒量取;洗涤时需要用到烧杯和玻璃棒;移液时需要移到500mL容量瓶中,定容时需要胶头滴管,故所需的玻璃仪器有:A.玻璃棒、B.烧杯、D.500mL量筒、E. 500mL容量瓶、F. 胶头滴管,故答案为ABDEF;
=0.456L=456mL;量取:依据计算的体积,用500mL量筒量取;洗涤时需要用到烧杯和玻璃棒;移液时需要移到500mL容量瓶中,定容时需要胶头滴管,故所需的玻璃仪器有:A.玻璃棒、B.烧杯、D.500mL量筒、E. 500mL容量瓶、F. 胶头滴管,故答案为ABDEF;
(3)过量的盐酸可抑制铁离子的水解,提高铁离子的浸出率,故酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(4)氯气与Fe2+反应生成Fe3+与Cl-,其离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;该过程中尾气有过量的氯化氢与氯气,需用氢氧化钠吸收,故答案为Cl2、HCl;
(5)得到的氯化铁溶液蒸发浓缩、冷却结晶后得到氯化铁晶体,故答案为蒸发浓缩、冷却结晶。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将锌片和铜片按不同方式插入稀硫酸中,下列说法正确的是( )
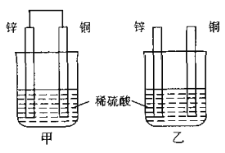
A. 甲中电子经导线从铜片流向锌片
B. 两烧杯中锌片上均发生还原反应
C. 两烧杯中铜片表面均无气泡产生
D. 一段时间后,两烧杯中溶液的c(H+)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向 1L 0.1mol·L-1 CH3COOH 溶液中加入 0.1molCH3COONa 固体,则溶液中![]() _____(填“增大”、“不变”或“减小”);写出该溶液中的电荷守恒关系_____。
_____(填“增大”、“不变”或“减小”);写出该溶液中的电荷守恒关系_____。
(2)土壤的 pH 一般在 4~9 之间。土壤中 Na2CO3 含量较高时,pH 可达 10.5,试用离子方程式解释土壤呈碱性的原因:_____。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为_____。
(3)水垢的主要成分 CaCO3 可以用过量食醋溶解,请结合化学用语,从沉淀溶解平衡的角度进行解释______________。
(4)常温下在 20mL0.1mol·L-1Na2CO3 溶液中逐滴加入 0.1mol·L-1HCl 溶液 40mL,溶液中含碳元素的各种微粒(CO2 因逸出未画出)物质的量分数(纵轴)随溶液 pH 变化的部分情况如图所示。回答下列问题:

①在同一溶液中 H2CO3 和CO![]() ____________________(填“能”或“不能”)大量共存。
____________________(填“能”或“不能”)大量共存。
②当 pH=7 时,溶液中含碳元素的最主要微粒为_____,溶液中各种离子的物质的量浓度的大小关系为_________。
③已知在 25℃时,CO![]() 水解反应的平衡常数
水解反应的平衡常数 =2.0×10-4,当溶液中c(HCO
=2.0×10-4,当溶液中c(HCO![]() ):c(CO
):c(CO![]() )=2:1 时,溶液的 pH=_____。
)=2:1 时,溶液的 pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述中正确的是
A.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
B.汽油、柴油、花生油都是多种碳氢化合物的混合物
C.有机物![]() 1mol最多可与3 mol H2发生加成反应
1mol最多可与3 mol H2发生加成反应
D.分子式为C15H16O2的同分异构体中不可能含有两个苯环结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,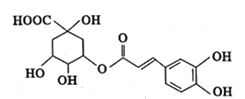
下列说法正确的是
A. 绿原酸的分子式为C16H20O9
B. 绿原酸分子中有4种含氧官能团
C. l mol绿原酸与NaOH溶液反应,可消耗7 mol NaOH
D. 绿原酸在酸性条件下的水解产物均能与NaHCO3发生反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O基态原子核外电子排布式为____。H2O VSEPR模型名称为_____,立体构型为___。O3____极性分子(填“是”或“不是”)。
(2)利用热化学法来测定晶格能是由Born与Haber首先提出来的,其实质是利用Hess定律,构成一个热化学循环。
已知:Na(s)+ ![]() Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
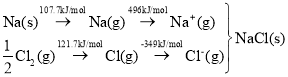
可知,Na原子的第一电离能为_____kJ·mol-1;Cl-Cl键键能为______kJ·mol-1;NaCl晶格能为_____kJ·mol-1。
(3)高压下NaCl 晶体和 Na 或 Cl2 反应,可以形成不同组成、不同结构的晶体,如图是其中一种晶体的晶胞(大球为氯原子, 小球为钠原子),其化学式为________。
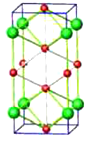
(4)金属Na晶体中的原子堆积方式称为体心立方堆积,晶胞参数为a nm,空间利用率为________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
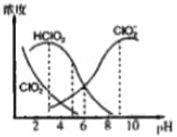
A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
A.υ正(N2)=υ正(H2)B.υ正(N2)=υ逆(NH3)C.3υ正(H2)=2υ逆(NH3)D.3υ正(N2)=υ逆(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com