
【题目】某同学设计如图装置制取少量溴苯,请回答下列问题:
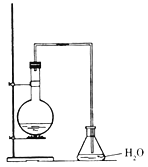
(1)写出实验室制取溴苯的化学方程式:___。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是___,这一现象能否说明溴和苯发生了取代反应(填“能”或“不能”)___,理由是___。
(3)反应后得到的溴苯中溶有少量苯、溴、三溴苯、溴化铁和溴化氢等杂质,欲除去上述杂质,得到无水溴苯的合理实验操作步骤可设计为(分液操作已略去):①水洗②碱洗③水洗④干燥⑤蒸馏。则上述操作②碱洗的主要目的是(填序号)___。
A.除三溴苯和溴化氢 B.除溴化铁和三溴苯
C.除溴和溴化氢 D.除苯和溴
【答案】C6H6+Br2![]() C6H5Br+HBr 浅黄色沉淀 不能 挥发出来的溴进入锥形瓶与水反应生成的溴离子与硝酸银溶液发生反应,生成淡黄色沉淀 C
C6H5Br+HBr 浅黄色沉淀 不能 挥发出来的溴进入锥形瓶与水反应生成的溴离子与硝酸银溶液发生反应,生成淡黄色沉淀 C
【解析】
(1)根据苯和液溴反应生成溴苯和溴化氢解答;
(2)溴化银为淡黄色沉淀;
(3)反应后得到的溴苯中溶有少量苯、溴、三溴苯、溴化铁和溴化氢等杂质,依据它们的性质不同除杂,根据碱的化学性质和除杂的成分解答。
(1)在催化剂的作用下,苯环上的氢原子溴原子所取代,生成溴苯,同时有溴化氢生成方程式为C6H6+Br2![]() C6H5Br+HBr;
C6H5Br+HBr;
(2)溴化氢与硝酸银反应生成浅黄色的溴化银和硝酸,且溴化银不溶于硝酸,因溴单质易挥发,所以进入锥形瓶的有挥发出来的溴单质,溴单质和水反应生成溴化氢和次溴酸,所以不能说明溴和苯发生了取代反应;
(3)氢溴酸和氢氧化钠反应生成易溶于水的溴化钠和水,溴单质和氢氧化钠反应,生成易溶于水的溴化钠和次溴酸钠,所以用氢氧化钠洗去溴单质和氢溴酸,故答案为:C。


科目:高中化学 来源: 题型:
【题目】实验室制备叔丁基苯(![]() )的反应和有关数据如下:
)的反应和有关数据如下:
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
物质 | 相对分子质量 | 密度/gcm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
AlCl3 | —— | —— | 190 | 易升华 | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | —— | 80.1 | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.85 | —— | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | —— | 169 | 难溶于水,易溶于苯 |
I.如图是实验室制备无水AlCl3可能需要的装置:
A.  B.
B. 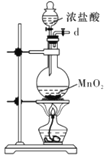 C.
C. 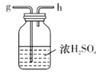 D.
D.  E.
E.  F.
F. 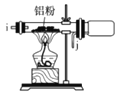
(1)检查B装置气密性的方法是__________。
(2)制备无水AlCl3的装置的合理的连接顺序为________(填小写字母),其中E装置的作用是___________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
II.如图是实验室制备叔丁基苯的装置(夹持装置略):

在三颈烧瓶中加入50mL的苯和适量的无水AlCl,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
使用恒压漏斗的优点是_________;加入无水MgSO4固体的作用是____________________________________。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是__________(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______________(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯的主链含有-NHCOO-重复单元的一类新型高分子化合物,其单体是氰酸酯(如O=C=N-R-N=C=O)和多元醇(如HO-R’-OH)。其高聚物结构式如图所示:
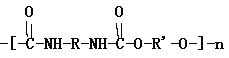
(1)由上述异氰酸酯和多元醇合成高聚物的反应属于___反应(填“加聚”,“缩聚”)。
(2)写出由2,6-甲基苯二异氰酸酯(如图所示) 和1,3-丙二醇为单体生成高聚物的化学方程式:___。
和1,3-丙二醇为单体生成高聚物的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为![]() ,下列有关咖啡酸的说法中,不正确的是( )
,下列有关咖啡酸的说法中,不正确的是( )
A.咖啡酸遇FeCl3溶液显紫色
B.咖啡酸可以发生加成、酯化、加聚等反应
C.1mol咖啡酸最多能与3molNaOH发生反应
D.1mol咖啡酸与饱和溴水反应,最多消耗2molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
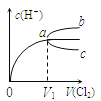
A.将饱和氯水加水稀释,溶液中c(H+)变化如曲线b
B.将饱和氯水降低温度,溶液中c(H+)变化如曲线c
C.在饱和氯水中加入NaOH使pH>7,所得溶液中存在下列关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-)
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有 PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
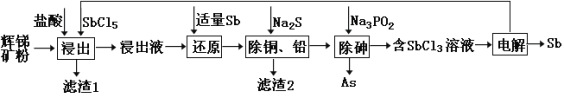
已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________。
(3)该生产流程能实现(填化学式)的循环利用 __________。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______。
所加Na2S也不宜过多,其原因为______________。
(5)“除砷”时有H3PO3生成,该反应的离子方程式为__________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
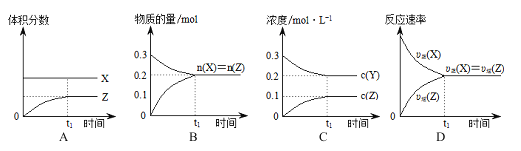
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com