
【题目】氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品。
(1) 等物质的量的氨和联氨分别与足量二氧化氮反应,产物为氮气和水。则转移的电子数之比为___________。
(2) 联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂N-H、N-N及N≡N各1 mol需吸收的能量依次为390.8 kJ、193 kJ、946 kJ。若生成1 mol N2,则反应________(填“放出”或“吸收”)___ _______kJ的能量。
(3)NH3-O2燃料电池的结构如图所示。
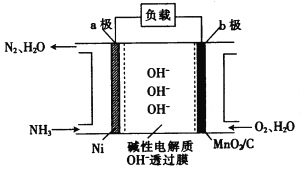
① a极为电池的________(填“正”或“负”)极。
②当生成1 mol N2时,电路中流过电子的物质的量为_____________。
(4)联氨可以高效地脱除烟道气中的NO从而生成 N2,该反应中氧化产物与还原产物的物质的量之比为__________。
【答案】
(1)3 : 4;
(2)放出;367
(3)①负;②6 mol;
(4)1 : 1;
【解析】
试题分析:(1)等物质的量的氨和联氨分别与足量二氧化氮反应,产物为氮气和水,氨气中N的化合价由-3价变成0价,N2H4 N的化合价由-2价变成0价,则转移的电子数之比为1×3:1×2×2=3:4,故答案为:3:4;
(2) 3N2H4(g)=N2(g)+4NH3(g)△H=3(390.8 ×4+193)-(946+4×3×390.8)=-367kJ/mol,则生成1 mol N2,需要放出367 kJ的能量,故答案为:367;
(3)① a极通入氨气,是负极,b极通入氧气,是正极,故答案为:负极;
②氨气中N的化合价由-3价变成0价,当生成1 mol N2时,转移电子的物质的量为6mol,故答案为:6mol;
(4)联氨可以高效地脱除烟道气中的NO从而生成 N2,反应的方程式为N2H4+2NO= 2N2+2H2O,该反应中氧化产物为N2,还原产物为N2,物质的量之比为1:1,故答案为:1:1。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素周期律的叙述中,正确的是
A. 氧化性强弱:F2<Cl2
B. 金属性强弱:K<Na
C. 酸性强弱:H3PO4<H2SO4
D. 碱性强弱:NaOH<Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每空分共(1)现有①硫酸②酒精③液氨④纯碱⑤熔融的氢氧化钠⑥水银⑦三氧化硫⑧澄清石灰水等物质中,属于盐的是(填序号,下同) ,属于酸性氧化物的是 ,能导电的是 ,属于电解质的是 。
(2)有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号 。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式 。
③画出甲元素的原子结构示意图 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素是指在人体内总量不到万分之一,质量总和不到人体质量的千分之一的二十多种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素不是微量元素的是
A.I
B.F
C.H
D.Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1mol任何气体的体积都是22.4L
B.1molH2 的质量是1g,它所占的体积是22.4L
C.在标准状况下,1mol任何物质所占的体积都约为22.4L
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计如图装置制检验氯气的某些性质。
(1)制取Cl2方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,检验干燥氯气是否有漂白性。
MnCl2+Cl2↑+2H2O,检验干燥氯气是否有漂白性。

①A装置中盛装浓盐酸的仪器的名称是 。
②B中盛有饱和食盐水,其作用是 , C中盛装的试剂是 。
③通入Cl2后,D、E中观察到的现象是 ;根据现象可得出的结论是 。
④F中盛有NaOH溶液,其作用是 。
(2)若撤去酒精灯,改用KMnO4氧化上述 HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
①该反应中的氧化剂是 。
②表现还原性的HCl与表现酸性的HCl的质量之比是_________。
③1mol KMnO4完全反应,被氧化的HCl的物质的量为 mol。
④8mol HCl完全反应,产生的Cl 2在标准状况下的体积为 升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
(1)下列说法正确的是__________(填字母序号)。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100 mL 1 mol·L-1 H2SO4加入100 mL含Ba2+ 0.137 g 的溶液中充分反应后,过滤出沉淀,滤液中残留的Ba2+的物质的量浓度为____________(保留三位有效数字)。
(3)将沉淀用100 mL纯水或100 mL 0.01 mol·L-1的H2SO4分别洗涤,两种情况下损失的BaSO4的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L﹣1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
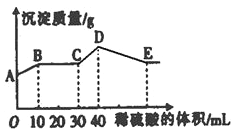
A.AB段发生反应的离子方程式为:Ba2++SO42—═BaSO4↓
B.E点对应横坐标稀硫酸的体积为70 mL
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点沉淀比A点沉淀质量大2.33g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com