
【题目】Ⅰ、氨气有广泛用途,工业上利用反应N2(g)+3H2 (g) ![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①有同学认为由条件a到b可能是加了催化剂。这种分析正确吗?理由是______。
②在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注______。

(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1____T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时H2的平衡分压为____MPa(分压=总压×物质的量分数)。
Ⅱ.工业上常用反应2NO2(g) ![]() N2(g)+2O2(g),△H=QkJ/mol实现绿色环保、废物利用。设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
N2(g)+2O2(g),△H=QkJ/mol实现绿色环保、废物利用。设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则
①Q_____0(填“> ”、“= ”或“< ").
②下列关于该反应说法不正确的是____
A.在恒温恒容的条件下,容器内气体颜色不变,说明该反应达到反应限度
B.如将该反应条件降低由恒温恒容改为恒温恒压,O2的百分含量将减小
C.在恒温恒容时,向平衡体系通入NO2,平衡正向移动,但NO2转化率将降低
D.增大压强,平衡逆向移动,说明逆反应速率增大,正反应速率减小。
③A点时,设容器的总压为a Pa,则其平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。B点时,NO2的转化率为____。
Ⅲ. N2O5(g)的分解存在两个平衡:①N2O5(g) ![]() N2O3(g)+O2(g); ②N2O3(g) N2O(g)+O2(g)T0C时,在一个2L的固定容积的密闭容器中,充入2 mol N2O5,平衡时测得N2O的浓度为0.25 mol/L,O2的浓度为0.75mol/L,则N2O的物质的量为__ mol,此时反应①的平衡常数为____ 。
N2O3(g)+O2(g); ②N2O3(g) N2O(g)+O2(g)T0C时,在一个2L的固定容积的密闭容器中,充入2 mol N2O5,平衡时测得N2O的浓度为0.25 mol/L,O2的浓度为0.75mol/L,则N2O的物质的量为__ mol,此时反应①的平衡常数为____ 。
【答案】错误,催化剂只能加快反应速率,不能改变平衡 <15>BDa/566.7%(或2/3)0.50.375
<15>BDa/566.7%(或2/3)0.50.375
【解析】
Ⅰ、(1)①从图像可知,在a、b两种条件下达到的平衡不同,不可能是使用催化剂,催化剂只能加快反应速率,不能改变平衡;
因此,本题正确答案是:错误,催化剂只能加快反应速率,不能改变平衡;
②体积缩小1/2,氢气的浓度会从c1突增到2 c1,然后根据缩小体积、增大压强,平衡右移,氢气的浓度减少但始终在c1与2 c1之间,画出t1时刻后c(H2)的变化曲线为: ;
;
因此,本题正确答案是:  。
。
(2)①该反应为放热反应,当压强不变的情况下,降低温度,平衡右移,氨气的体积分数增大,从图像看出,T1小于T3;
因此,本题正确答案是:<。
②设氮气的变化量为xmol,根据反应,
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始量 9 23 0
变化量 x 3 x 2 x
平衡量 9- x 23-3x 2 x
氨气的体积分数= 2x÷(9- x+ 23-3x+2x)=60%,解之x=6mol;把x=6带入下式可得:
H2的物质的量分数=(23-3x)÷(9- x+ 23-3x+2x)=![]() ,此时H2的平衡分压为60×1/4=15;
,此时H2的平衡分压为60×1/4=15;
因此,本题正确答案是:15;
Ⅱ. ①根据图像曲线变化,随温度升高,N2和O2浓度增大,NO2浓度减小,故正反应为吸热反应,△H>0,
②A.容器内气体颜色不变,说明浓度不变,该反应达到反应限度,故A正确;
B.反应 2NO2(g) ![]() N2(g)+2O2(g)为气体体积增大的反应,如将该反应条件由恒温恒容改为恒温恒压,相当于减小压强,平衡正向移动,O2的百分含量将增大,故B错误;
N2(g)+2O2(g)为气体体积增大的反应,如将该反应条件由恒温恒容改为恒温恒压,相当于减小压强,平衡正向移动,O2的百分含量将增大,故B错误;
C.在恒温恒容时,向平衡体系通入NO2,相当于加压,平衡逆向移动,NO2转化率降低,故C正确;
D.增大压强,正逆反应速率都增大,但逆反应速率增大倍数大于正反应速率增大的倍数,平衡逆向移动,故D错误;
答案选BD。
③根据化学方程式2NO2(g) ![]() N2(g)+2O2(g)及图示数据,A点时,NO2是10mol,O2是10mol,N2是5mol,因为容器的总压为a Pa,所以N2的分压是
N2(g)+2O2(g)及图示数据,A点时,NO2是10mol,O2是10mol,N2是5mol,因为容器的总压为a Pa,所以N2的分压是![]() a Pa,NO2和O2的分压都是
a Pa,NO2和O2的分压都是![]() a Pa,则平衡常数Kp=
a Pa,则平衡常数Kp=![]() =
=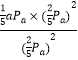 = a/5 Pa。
= a/5 Pa。
B点时,N2和NO2的物质的量相等,设为xmol,则O2为2xmol,NO2转化率为![]() ×100%=66.7%(或2/3)。
×100%=66.7%(或2/3)。
因此,本题正确答案是:a/5 Pa;66.7%(或2/3);
Ⅲ.设平衡时剩余N2O5的物质的量是x,所以消耗N2O5是2-x,则反应①中生成N2O3和氧气都是2-x。由于平衡时O2为0.75mol/L×2L=1.5mol,N2O为0.25 mol/L×2=0.5mol,所以反应②中生成氧气是0.5mol,则消耗N2O3是0.5mol,所以有(2-x)-0.5=0.25mol/L×2,解得x=1mol,
此时反应①的平衡常数为K=![]() =
=![]() =0.375,
=0.375,
因此,本题正确答案是:0.5;0.375。


科目:高中化学 来源: 题型:
【题目】中和热测定实验中,下列操作会使测得的H偏小的是( )
A.大烧杯上没有盖硬纸板
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒
C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类和实验探究都是中学化学重要的学科思想。
(一)以下是对“一些物质与水反应”的分类图,请按要求填空:

上述分类方法是______;A组物质中属于电解质的是_____(填化学式);C组物质与水反应的离子方程式为_____;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是___(填化学式)。
(二)用质量分数为98%的浓硫酸(密度为1.84 g·cm3)配制240 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是______(填序号)。

下列操作会使配制结果偏高的是_______(填序号)
A 容量瓶用蒸馏水洗净后,未进行干燥处理
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯
C 未冷却,即将溶液注入容量瓶并定容
D定容时,俯视容量瓶的刻度线
(三)某小组用如下装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。

实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。
请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是_________。
(2)B中溶液发生反应的离子方程式是_______________。
(3)步骤③实验的目的是确认C的黄色溶液中无_____(填化学式)。步骤④能否说明非金属性:Br>I_______(填“能”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是

A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可以用电解熔融氯化钠的方法来制取金属钠
B. 加热后才能发生的化学反应是吸热反应
C. 共价化合物中一定含有共价键,可能含有离子键
D. 1mol乙酸与1mol乙醇反应生产乙酸乙酯的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应A(g)+B(g)![]() xC(g),有下图所示的关系曲线,根据下图下列判断正确的是
xC(g),有下图所示的关系曲线,根据下图下列判断正确的是

A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示混合气体的密度
C.p3<p4,y轴表示B的质量分数
D.p3<p4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.离子键就是阴、阳离子间的静电引力和静电斥力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合形成离子键
D.在离子化合物 CaCl2 中,两个氯离子间也存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质电离方程式:
Na2CO3__________________;
NH3·H2O_________________;
(2)写出下列物质水解的离子方程式:
NaHCO3__________________;
FeCl3___________________;
(3)常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH为_______。
(4)用pH试纸测定溶液pH的操作是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com