
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
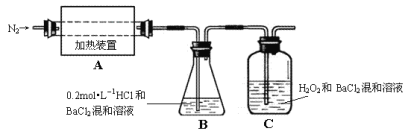
①A中固体充分加热较长时间后,通入氮气,目的是___。
②为验证A中残留物是否含有FeO,需要选用的试剂有___。
A.KSCN溶液 B.浓盐酸 C.KMnO4溶液 D.稀硫酸
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有__气体生成,若含有该气体,观察到的现象为__。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为amol,C中沉淀物质的量为bmol,则b__a(填“大于”、“小于”或“等于”)
⑤现欲将B中溶液准确稀释至100.00mL,应将锥形瓶中的溶液转移入__(填仪器名称)定容。
⑥实验中,观察到C中有白色沉淀生成,则C中发生的反应为__。
【答案】SO2 使分解产生的气体在B、C中被充分吸收 CD SO3 溶液变浑浊 小于 100mL容量瓶 SO2+H2O2=2H++SO42-、SO42-+Ba2+=BaSO4↓(或SO2+H2O2+Ba2+=BaSO4↓+2H+)
【解析】
(1)氮元素和铁元素化合价升高,根据氧化还原反应的规律可知,化合价降低的应该是S元素;
(2)①通入氮气可以使分解生成的气体被完全吸收;
②验证A中残留物是否含有FeO,可将残留物溶于硫酸中,加入KMnO4溶液,观察KMnO4溶液是否褪色;
③氯化钡可与SO3反应生成白色沉淀;
④根据化合价升降守恒进行判断;
⑤准确的配制溶液的仪器为容量瓶;
⑥C中SO2被H2O2氧化为SO42-,SO42-与Ba2+结合生成白色沉淀。
(1)根据氧化还原反应规律,Fe、N元素的化合价均升高,则一定有降低的元素,从所给的产物判断,产物中还应有SO2;
(2)①氯化钡与稀盐酸的混合液目的是吸收氨气、三氧化硫,则过氧化氢和氯化钡的混合液主要吸收二氧化硫,所以通入氮气的目的是使分解产生的气体在B、C中被充分吸收;
②为验证A中残留物是否含有FeO,则选择稀硫酸将固体溶解,然后加入酸性高锰酸钾溶液,若溶液褪色或变浅,证明溶液中含有亚铁离子,则固体中含有FeO;
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有三氧化硫,若含有三氧化硫,则溶液中有硫酸钡沉淀生成,溶液变浑浊;
④若产物中有氮气生成,则失去电子的元素是Fe和N,得到电子的元素是S,根据得失电子守恒,生成bmolFe2O3失去电子的物质的量是2bmol,C中沉淀物质的量为amol,即生成的二氧化硫的物质的量是amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则2b小于2a,所以b<a;
⑤标准溶液配制,需要容量瓶,由于配制100.00mL溶液,所以需要100mL容量瓶;
⑥C中的白色沉淀是硫酸钡沉淀,二氧化硫与过氧化氢、氯化钡溶液发生氧化还原反应而生成硫酸钡沉淀,离子方程式为SO2+H2O2=2H++SO42-、SO42-+Ba2+=BaSO4↓(或SO2+H2O2+Ba2+=BaSO4↓+2H+)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.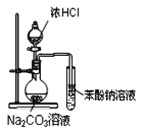 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)aFeb(SO4)c·dH2O又称莫尔盐,是浅绿色晶体,用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
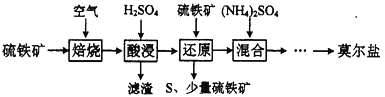
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:__________________________。实验室检验“还原”已完全的方法是:__________________________。
(2)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式(请写出计算过程)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图填空:

反应物是________;生成物是________。在2 min内A、B、C三者的反应速率值分别是____________、____________、____________,该反应的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
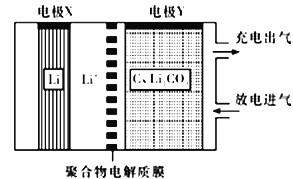
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
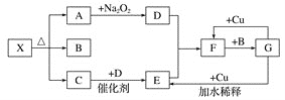
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com