
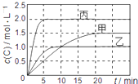
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度 | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.物质A的化学计量数x=2
D.保持甲容器体积不变,向其中通入He气体,达到新平衡后,C的百分含量减小
【答案】B
【解析】
A. 由图可知:5min时 c(C)关系为乙>甲,说明反应速率乙>甲,温度T1<T2;平衡时c(C)关系为乙<甲,说明温度低有利于平衡的正向移动,则正反应为放热反应,A错误;
B. 利用三段式进行分析(x=1,分析过程见C选项)
A(g)+B(g)![]() 2C(g)
2C(g)
起始量 1mol/L 3mol/L 0
变化量 0.5mol/L 0.5mol/L 1mol/L
平衡量 0.5mol/L 2.5mol/L 1mol/L
![]() B正确;
B正确;
C. 比较乙和丙,温度相同,丙中反应物的浓度分别为乙中反应物浓度的2倍;从图中可以看出,平衡时丙中c(C)也为乙中c(C)的2倍,说明压强改变平衡不发生移动,反应前后气体的分子数相等,从而得出x=1,C错误;
D. 保持甲容器体积不变,向其中通入He气体,气体的浓度不变,平衡不发生移动,C的百分含量不变,D错误。
故答案为B。


科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有利于更好的开发和使用化学能源。
(1)金属镁[Mg(s)]分别与卤素单质[F2(g)、Cl2(g)、Br2(l)、I2(s)]反应的能量变化如图所示。

①写出Mg(s)和I2(s)反应的热化学方程式:_______。
②反应:MgCl2(s)+F2 (g)=MgF2(s)+Cl2 (g)的ΔH=___________。
(2)CH4用NiO作载氧体的化学链燃烧示意图如图所示。

主要热化学反应如下:2Ni(s)+O2(g)=2NiO(s) ΔH=-479.8 kJ·mol-1;CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ΔH=+68.9 kJ·mol-1
①CH4的燃烧热是_______。
②CH4的“化学链燃烧”有利于二氧化碳的分离与回收,所放出的热量在相同条件下与CH4的直接燃烧相比_________(填“前者大”、“后者大”、或“相同”)。
(3)已知H2、CO的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1,25℃时,4 g H2和28 g CO的混合气体充分燃烧,恢复至原温,能放出的热量为_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期部分元素原子半径与原子序数的关系如图,下列说法正确的是
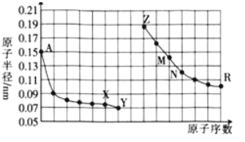
A.相同条件下,Y的氢化物比X的氢化物更稳定,熔沸点也更高
B.A单质通常保存在煤油中
C.Y的单质能从含R简单离子的水溶液中置换出R单质
D.M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.25g金属Zn恰好与250mL某浓度的盐酸完全反应,计算:
(1)该盐酸的物质的量浓度;___________
(2)标准状况下,该反应生成的气体的体积。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海水综合利用中,下列叙述不正确的是( )
A.海水经过蒸发结晶得到粗盐
B.海水中提取镁单质的方法是海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
C.海水提镁的工艺中用贝壳为原料生产石灰乳
D.海水中提取溴单质可以用氯气将海水中的Br-氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
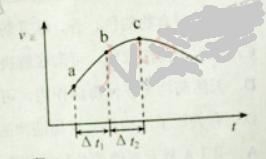
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g) △H=﹣129.0KJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___。
(2)将1.0molCH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1。

①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为___。
②100℃时反应I的平衡常数为___。若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将___移动(填“正向”、“逆向”或“不”)。
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3molH2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为aL。
①反应达到平衡后,A内压强为起始压强的![]() ,则平衡时A容器中H2的体积分数为__。
,则平衡时A容器中H2的体积分数为__。
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6aL,则打开K2之前,B容器的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】味精的成分为谷氨酸钠。用丙烯合成谷氨酸钠的一种方案如下:
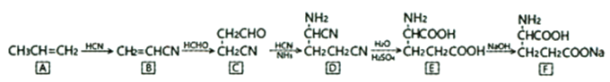
回答下列问题:
(1)E(谷氨酸)中的官能团名称是________。
(2)B→C的反应类型为________。
(3)A→F六种有机物中,含有手性碳原子的是________。
(4)D→E的化学方程式为________。
(5)有人造羊毛之称的腈纶纤维是B的加聚产物,该聚合物结构简式为________。
(6)写出一种核磁共振氢谱只有三组峰,且面积比为6:2:1的E同分异构体的结构简式________。
(7)参考丙烯合成谷氨酸钠方案设计苯乙烯(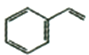 )为原料制备苯丙氨酸(
)为原料制备苯丙氨酸(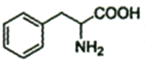 )的合成路线(无机试剂任选)__。
)的合成路线(无机试剂任选)__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com