
科目: 来源: 题型:
【题目】BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。

(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:
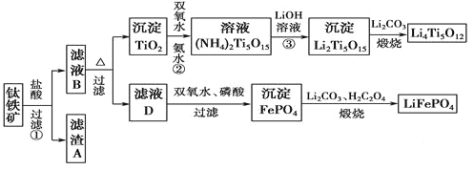
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式为 。
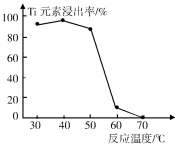
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知298 K时,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
如果反应5分钟达到平衡时气体总物质的量为2.5mol,则这段时间内氢气的反应速率为 ,达平衡时氮气的转化率为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。



图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]()
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为探究草酸的性质并制备草酸钠及其用途,查阅到如下信息:

探究草酸部分性质并制备草酸钠的生产流程如下:
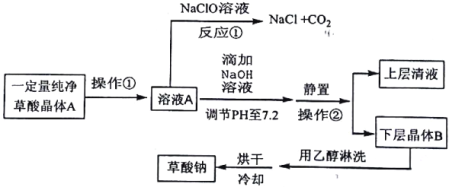
请回答下列问题:
(1)写出反应①的化学方程式__________。表明草酸具有__________性。
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是__________。该反应达到终点时的化学方程式为__________。
(3)操作②的名称是__________。用乙醇淋洗晶体B的目的是__________
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会__________:操作中需用__________滴定管(填“酸式”或“碱式”),当达到反应终点时的现象是__________;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为__________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】
(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为 。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48 L,通入足量的溴水,溴水质量增加2.8 g,此两种烃的组成为 (填分子式)。
(3)某烃是一种比水轻的油状液体,相对分子质量为78,碳元素与氢元素的质量比为12:1,不能使溴水和酸性高锰酸钾溶液褪色。写出此烃发生取代反应的化学方程式(任意写一个即可) 。
(4)2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,已知此有机物可以发生催化氧化反应,写出此反应的化学方程式 。
(5) 有机物的结构可用“键线式”表示,如:![]() 可简写为
可简写为![]()
![]() 可简写为
可简写为 ![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,![]() ,苧烯的分子式为 。
,苧烯的分子式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:

(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
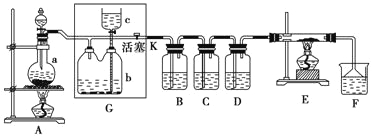
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为______。
(2)如何检查装置G的气密性:______(写出操作方法和现象)。
(3)G中b瓶内宜加入的液体是______;实验开始后B中的现象是______,C中的现象是______,F的现象是______。
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3,还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下:

(1)滤渣A是 ,滤渣B是 。
(2)过程I、II、III的分离操作的名称是 。
(3)过程IV中灼烧时盛放药品的仪器名称是 ,发生反应的化学方程式是 。
(4)过程III中发生反应生成滤渣C的离子方程式表示为 。
(5)取滤液B100mL,加入1molL-1盐酸200mL时,沉淀量达到最大且质量为11.7g。则溶液B中c(Al[(OH)4]-)= ,c(Na+)> mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系![]() ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为 ;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为 ;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
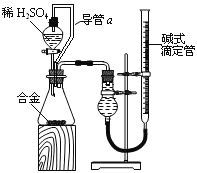
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和 ;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=_____L·moL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com