
科目: 来源: 题型:
【题目】将金属a放入b(NO3)2溶液中发生如下反应:a+b2+===a2++b,则下列说法正确的是( )
A.常温下,a或b可以与水发生反应
B.a与b用导线连接插入稀H2SO4中,则形成原电池且b极上有H2放出
C.a与b用导线连接插入b(NO3)2溶液中一定构成原电池
D.用惰性电极电解a(NO3)2与b(NO3)2的混合液,在阳极先析出b
查看答案和解析>>
科目: 来源: 题型:
【题目】现有灼烧了一段时间的碳酸钙样品16g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2g,则原固体混合物中钙元素的质量分数为 ()
A.50%B.40%C.60%D.70%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.Al2O3用作耐火材料、Al(OH)3用作阻燃剂
B.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金
C.自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在 [
D.通过化学变化可以实现12C与14C间的相互转化
查看答案和解析>>
科目: 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g) + Y(g) ![]() nZ(g) + 2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/ (L·min),则n的值为
nZ(g) + 2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/ (L·min),则n的值为
A.4 B.3 C.2 D.1
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
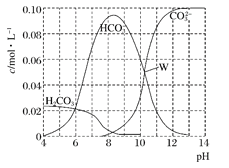
A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。

(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g) ![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
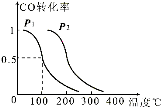
①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
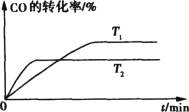
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)![]() =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)![]() =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置.

回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)装置A中,仪器a的名称叫 ,该仪器中盛有的试剂为 .
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值 7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为 色,反应的离子方程式为 .
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么? .
(5)装置E的作用是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
已知:2C(s)+O2(g)![]() 2CO(g)△H=﹣221.0kJmol-1
2CO(g)△H=﹣221.0kJmol-1
C(s)+O2(g)![]() CO2(g)△H=﹣393.5kJmol-1
CO2(g)△H=﹣393.5kJmol-1
则N2(g)+O2(g)=2NO(g) △H = kJmol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
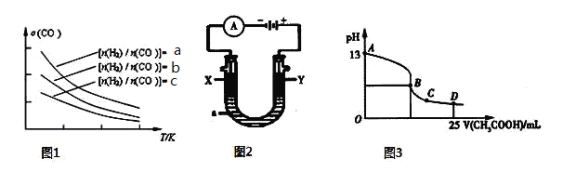
① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
2 | C | N | O | |||||
3 | Na | Mg | Si | S | Cl | Ar | ||
4 | Ca |
(1)化学性质最不活泼的元素是 (填元素名称);
(2)N原子结构示意图为 ;Ca的最外层电子数为 .
(3)第
(4)C、N和O原子半径由小到大的顺序的是 ;
(5)第2周期中气态氢化物最稳定的是 ;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是 (写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是 该物质的焰色反应为 色,它暴露在空气中易潮解是因为还含有 .
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子的结构如图所示,下列说法正确的是( )

A.N4属于一种新型的化合物
B.N4与N2的摩尔质量相等
C.等质量的N4与N2所含的原子个数比为1∶1
D.等质量的N4与N2所含的原子个数比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com