
科目: 来源: 题型:
【题目】下列哪一实例能说明微量元素是生命活动所必需的
A. Mg是叶绿素不可缺少组成成分 B. 人体内K+含量过少会出现低钾症
C. 哺乳动物血液中Ca2+盐含量太低会抽搐 D. 人体内Fe2+的含量过低会导致贫血
查看答案和解析>>
科目: 来源: 题型:
【题目】实验现象描述错误的是
A. 碘单质受热升华:紫色蒸气 B. 硫磺在氧气中燃烧:蓝紫色的火焰
C. 铁丝在氯气中燃烧:棕褐色的烟 D. 氢气在氯气中燃烧:淡蓝色火焰
查看答案和解析>>
科目: 来源: 题型:
【题目】将面团包在纱布中并放在清水中搓洗,检测黏留在纱布上的黏稠物质和洗出的白浆物质所用的试剂分别是
A. 碘液、苏丹Ⅲ染液 B. 碘液、斐林试剂
C. 双缩脲试剂、捵液 D. 双缩脲试剂、斐林试剂
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列九种物质:①盐酸 ②石墨 ③蔗糖 ④CO2 ⑤熔融NaHSO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧硫酸 ⑨明矾
(1)属于电解质的有_________________________;
属于非电解质的有__________________________;
能导电的物质有____________________________。
(2)②和SiO2在高温下可发生如下反应:
3C+SiO2![]() SiC+2CO
SiC+2CO
上述反应中还原产物是 ;氧化剂与还原剂物质的量之比为 。
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为________________________
(4)⑤的电离方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问題:
(1)以上八种元素中非金厲所形成的最简单气态氢化物稳定性最弱的是_________(填化学式),E、F、H 所形成的简单离子的半径由大到小的顺序为_________(用离子符号表示)
(2)一定条件下,A的单质气体与C的单质气体充分反应生成W气体,W的结构式_____。由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_____。固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为________________。
(3)G是非金厲元素,其单质在电子工业中有重要应用,请写出G的最髙价氧化物与B的单貭在高温下发生置换反应的化学反应方程式____________________。
(4)10L的密闭容器中,通入2mol的HD2气体和1molD2的气体单质,一定条件下反应后生成HD3气体,当反应达到平衡时,单质D的浓度为0.01mol·L-1,同时放出约177KJ的热量,则平衡时HD2的转化率为____________;该反应的热化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,制备少量Mg(ClO3)2·6H2O的工艺流程如下:

已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如右图所示。
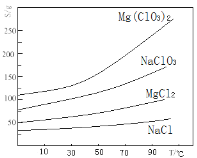
(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;② ;③ ;④过滤、洗涤。
(3)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1 FeSO4溶液,微热。此过程中反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定步骤2中多余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4: ,平均消耗K2Cr2O7 溶液15.00 mL。
①题中所用FeSO4溶液中,常加入适量稀硫酸和铁粉以抑制其变质。其中,加稀硫酸的作用是(用离子方程式解释): 。
②步骤4中空缺的内容为 。
③产品中Mg(ClO3)2·6H2O(摩尔质量为299g/mol)的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,浓度都是1mol·L﹣1的两种气体X2和Y2,在密闭容器中发生反应生成气体Z,反应2min后,测得参加反应的X2的浓度为0.6mol·L﹣1,用Y2的浓度变化表示的化学反应速率v(Y2)=0.1mol·L﹣1·min﹣1,生成的c(Z)为0.4mol/L.则该反应的化学方程式是( )
A. X2+2Y2![]() 2Z B. 2X2+Y2
2Z B. 2X2+Y2![]() 2Z C. 3X2+Y2
2Z C. 3X2+Y2![]() 2Z D. X2+3Y2
2Z D. X2+3Y2![]() 2Z
2Z
查看答案和解析>>
科目: 来源: 题型:
【题目】断裂1 mol化学键所需的能量如下:
化学键 | N—N | O=O | N≡N | N—H |
键能(kJ) | 154 | 500 | 942 | a |
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是

A.N2比O2稳定
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.表中的a=194
D.图中的ΔH3=+2218 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】①某NaCl样品中可能含有SO42-、CO32-,为检验杂质离子的存在,采取如下实验步骤:
样品![]() 无明显现象
无明显现象![]() 无明显现象。
无明显现象。
则加入的试剂A为 ,B为 (填化学式),该现象证明样品中不含有 。
②在后续实验中需要使用450mL0.5 mol·L-1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl g。
③配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是( )
A.称量时NaCl已潮解 |
B.天平砝码已锈蚀 |
C.定容时俯视刻度线 |
D.定容摇匀后液面下降,又加水至刻度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com