
科目: 来源: 题型:
【题目】下列基本实验操作中,不合理的是( )
A. 分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁
B. 可用湿润的红色石蕊试纸检验氨气
C. 稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水
D. 试管可用酒精灯直接加热,也可用水浴加热
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1) TY2是一种常用的溶剂,是__________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
(2)W的最简单氢化物容易液化,理由是__________,.放热419 kJ,该反应的热化学方程式为 __________。
(3)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的第一电离能由大到小的顺序为_________(用元素符号作答)。
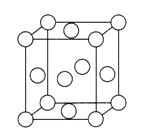
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为___________cm;ZYO4常作电镀液,其中ZYO42-的空间构型是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
查看答案和解析>>
科目: 来源: 题型:
【题目】用钠镁铝分别与盐酸反应填写下面几种情况的空白:
(1)称取相同质量的钠镁铝,然后分别与足量盐酸反应,则产生的氢气在通常条件下的体积之比为_____________。
(2)取相同物质的量的钠镁铝,分别与足量盐酸反应,则产生氢气质量之比为_________。
(3)如果要制取相同体积的氢气(同温同压下),与足量的盐酸分别反应时所消耗的钠镁铝的物质的量之比为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
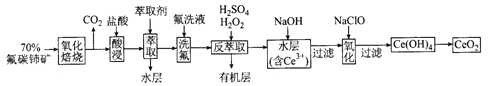
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
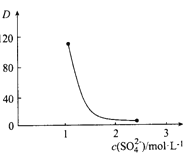
(3)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6 g。则原混合气体中CO2和H2O的物质的量之比是( )
A.1:4 B.3:11 C.1:11 D.21:22
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.如果5.6LN2含有n个氮分子,则NA一定约为4n
B.18g水中所含的电子数是8NA
C.在0.5mol/L的氯化钡溶液中含有离子数为1.5NA
D.15gCH3+含有8mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。
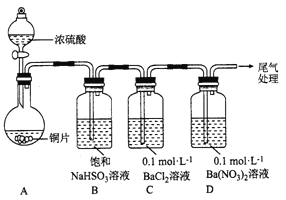
① A中反应的化学方程式是______________。
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现由色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价疏元素的物质性质继续进行探究。
序兮 | 实验搡作 | 实聆现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加人10mL 2 mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡,滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2 mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:________________。
② 由实验1、2、3对比,可以得到推论:________________。
③乙通过査阅资料发现.Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和 NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取____固体混合物,向其中加入10mL2 mol /LHNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;:滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:C1-的存在可以加快溶液中+4价硫元索的氧化;
ii.实验I和4对比,乙获得推论: ______________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加____________ (填字母序号)。
a.2 mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
B.2 mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
C.2 mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
D.2 mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】一同学欲从量筒中取出部分液体,他先俯视凹液面的最低处,读数为50mL,倒出液体后,他又仰视凹液面的最低处,读数为10mL他实际倒出液体的体积为( )
A.40mL
B.大于40mL
C.小于40mL
D.不一定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 价电子数与最高化合价相等的元素一定是主族元素
B. 次外层全充满而最外层有不成对电子的元素一定是主族元素
C. 所有非金属元素都在p区
D. 元素周期表的5个区中都有金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com