
科目: 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目: 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F是一种关节炎止痛药,合成F的一种传统法的路线如下:
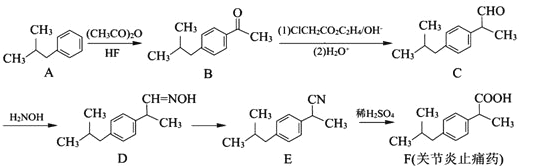
(1)B中含氧官能团的名称为_________。
(2)C→D的反应可分为两步,其反应类型为_________、_________。
(3)写出比F少5个碳原子的同系物X的结构简式:_______________(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有_______________种。
①属于芳香族化合物;②苯环上只有1个取代基;③属于酯类物质;
(4)写出E转化为F和无机盐的化学方程式:______________________。
(5)已知:①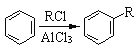
② 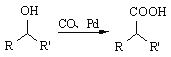 (R1、R2表示烃基)
(R1、R2表示烃基)
合成F的一种改良法是以2—甲基—1—丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________________
CH3CH2OH__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A . N2,H2的和NH3的质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C .N2和H2的物质的量之和NH3的物质的量的2倍
D. 单位时间内每增加1molN2,同时增加3molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的可再生资源。
(1)已知:2CH4(g)+O2(g) =2CO(g)+4H2(g) △H=akJmol-1
CO(g) +2H2(g)=CH3OH(g) △H=bkJmol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式:____________________________。
(2)反应:CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K的表达式为________________;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________。
CH3OH(g)的平衡常数K的表达式为________________;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________。
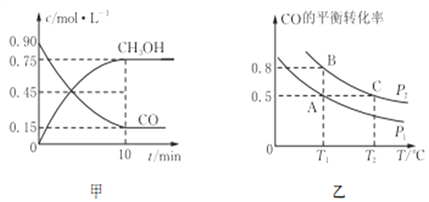
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图乙所示。
①能判断该反应达到化学平衡状态的是_______(填选项字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较A、B两点压强大小P(A)________P(B)(填“>、<、=”)。
③比较KA、KB、KC的大小:________________。
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,写出燃料电池负极的电极反应式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铝分别和O2、O3反应生成Al2O3,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。下列有关说法中不正确的是
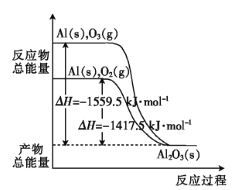
A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH=-1559.5kJ·mol-1
B. 等质量的O2比O3的能量低,O2比O3稳定
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. Al(s)与O2(g)反应的热化学方程式为4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2835kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:

环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。

Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质和对应用途的描述均正确的是
A. SiO2硬度大,可用于制造光导纤维
B. 碳具有还原性,可用碳在高温下将二氧化硅还原为硅
C. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
D. 汽油是常见的有机溶剂,可以用裂化汽油来萃取溴水中的溴
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO![]()
b.2HCOOH+CO![]() =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO![]()
d.Cl2+H2O+2CO![]() =2HCO
=2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com