
科目: 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体13.44 L,质量为20 g,该混合气体中,碳与氧两种原子的数目之比为_____________________。
(2)在三个同温同体积的容器中,分别充入等质量的 ①H2 ②CO2 ③O2三种气体,则容器内压强由大到小的顺序为____________(填序号)。
(3)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl,则ACl2的化学式是__________。
(4)某物质A加热时按下式分解:2A═2B+C+3D(产物均为气体),现测得由生成物组成的混合物气体密度是H2密度的23倍,则反应物A的摩尔质量为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物Ⅰ反应生成化合物Ⅱ,如反应所示(其他试剂、产物及反应条件均省略).
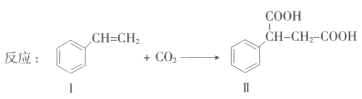
(1)化合物Ⅰ的官能团名称为___________,分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 .
(2)写出化合物Ⅰ在一定条件下的加聚反应方程式___________。(不需要注明反应条件).
查看答案和解析>>
科目: 来源: 题型:
【题目】Al是应用广泛的轻金属。下列关于Al的说法不正确的是( )
A. 化学性质活泼 B. 在稀HNO3中钝化
C. 能与盐酸反应 D. 能与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A. 1mol醋酸的质量与NA个醋酸分子的质量相等
B. NA个氧分子和NA个氮分子的质量比等于8:7
C. 28g氮气所含的原子数目为NA
D. 在标准状况下,0.5NA个氯气分子所占体积约是11.2L
查看答案和解析>>
科目: 来源: 题型:
【题目】煤制合成天然气是煤气化的一种重要方法,其工艺核心是合成过程中的甲烷化,涉及的主要反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH<0 ①
CH4(g)+H2O(g) ΔH<0 ①
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0 ②
CH4(g)+2H2O(g) ΔH<0 ②
现在300 ℃、容积为2 L的密闭容器中进行有关合成天然气的实验,相关数据记录如下:
CO/mol | CO2/mol | H2/mol | CH4/mol | H2O/mol | |
0 min | 4 | 3 | 40 | 0 | 0 |
30 min | 2 | 2 | a | 3 | |
70 min | 1 | b | c | d | 6 |
下列有关说法错误的是
A.a=30,b=1.5
B.c=25,d=4.5
C.前30 min内,反应①的平均反应速率v(CH4)=0.05 mol·L1·min1
D.后40 min内,反应②的平均反应速率v(H2)=0.025 mol·L1·min1
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5在一定温度下可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.用于提纯或分离物质的常见方法有:A、萃取 B、加热分解 C、结晶 D、分液 E、蒸馏 F、过滤等,请将提纯或分离的方法填在相应的横线上(填写序号)。
(1)硝酸钾溶液中混有少量氯化钠 __________________;
(2)氧化钙中混有少量的碳酸钙 ____________________;
(3)分离碳酸钙和水 ______________________________;
(4)分离植物油和水 ______________________________;
(5)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶)_________。
Ⅱ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从_____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是________________。
(4)粗盐中含Ca2+、Mg2+、Fe3+、![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③过滤 ④加入过量的NaOH溶液 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③过滤 ④加入过量的NaOH溶液 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发
操作顺序合理的是_________(填字母)。
a.⑤②④①③⑥⑦ b.⑤①②④③⑥⑦
c.⑤②①④⑥③⑦ d.⑤④②①③⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是人类宝贵的自然资源。下图是某工厂对海水资源综合利用的部分流程示意图。


(1)请列举海水淡化的两种方法__________、__________。
(2)精制的食盐水通过离子交换膜电解槽电解。上图为离子交换膜法电解原理示意图。电解饱和食盐水的离子方程式为______________________,试根据电极反应分析透过交换膜的离子X是__________。
(3)已知[Ca(OH)2=5.5×l0-6,Mg(OH)2=1.8×l0-11]。将c(Mg2-)=3.6×l0-3mol/L 的 MgCl2溶液与 cmol/L的NaOH溶液等体积混合,要使混合液产生Mg(OH)2沉淀,c至少等于__________mol/L。经步骤③所得的Mg(OH)2沉淀中常混有Ca(OH)2,怎样除去?写出你的方案:_____________________________。
(4)工业制取镁首先用MgCO3进行热分解,笫二步加焦炭进行氯化得到MgCl2,最后通过电解MgCl2制取Mg,写出该法笫二步的化学方程式__________________________________________。电解熔融氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是__________(选填编号字母)。
A.Cl2 B.N2 C.H2 D.空气
(5)甲同学认为:步骤③后可加热Mg(OH)2沉淀得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。乙不同意甲的观点,他的理由是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com