
科目: 来源: 题型:
【题目】下列关于铵盐的叙述中不正确的是
A. 常温下,都是易溶于水的晶体
B. 可用作氮肥
C. 热稳定性差,加热分解时一定产生NH3和酸
D. 跟强碱共热时,有氨气放出
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生.
(1)摩擦剂中氢氧化铝的定性检验.
取适量牙膏样品,加水充分搅拌、过滤.
往滤渣中加入过量NaOH溶液,过滤,滤液中通入过量二氧化碳,请写出通入过量二氧化碳反应的离子方程式是 .
(2)牙膏样品中碳酸钙的定量测定.
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.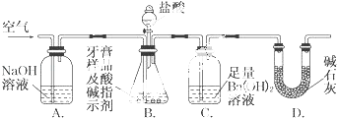
依据实验过程回答下列问题:
(i)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有
(ii)C中反应生成BaCO3的化学方程式是
(iii)下列各项措施中,不能提高测定准确度的是(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(iv)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为
(v)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:

写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:

①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】将适当的数据填写在空格中:
(1)0.5molNaOH的质量是g,10gNaOH的物质的量是mol.
(2)在标准状况下0.5molH2的体积为L,在标况下5.6LH2的物质的量为mol.
(3)将58.5gNaCl溶于水配制成500mL溶液,此溶液中溶质的物质的量浓度为;取此溶液100mL,其中Na+的物质的量浓度为 , Na+的物质的量是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物.一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如图1: 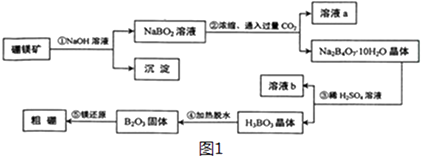
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为、 .
(2)写出步骤①的化学方程式 .
(3)写出步骤②的离子方程式 .
(4)步骤③中化学反应可以发生的原因是 .
(5)过硼酸钠晶体(NaBO34H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结
晶水. 实验测得过硼酸钠晶体的质量随温度变化的情况如图2所示,则T2℃时所得晶体的化学式为 . 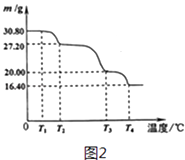
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com