
科目: 来源: 题型:
【题目】物质A~K有如下的转化关系,其中D、E为气体单质,试回答(图中有些反应的产物和反应的条件没有全部标出): 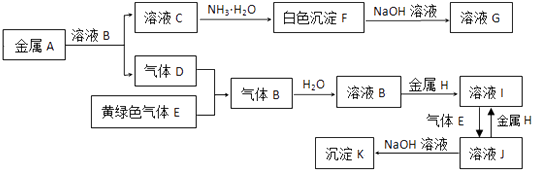
(1)写出下列物质的化学式:D是 , G是;
(2)写出“C→F”反应的离子方程式;
(3)写出反应“F→G”的离子方程式;
(4)写出反应“I→J”的离子方程式;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是;写出相关的化学反应方程式 .
(6)向200mL 3mol/L溶液J中加入60g铁、铜混合物(铁和铜的物质的量比为1:1),充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体的质量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O2NH3+ ![]() O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10﹣6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为molh﹣1 .
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 . 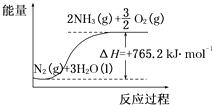
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 在某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L.求: ①该条件下的平衡常数为;
②若向该容器中加入a mol N2、b mol H2、c mol NH3 , 且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量(填“>”“<”或“=”)92.4kJ.
查看答案和解析>>
科目: 来源: 题型:
【题目】从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
② | 浓硫酸可除去烧瓶内残留的MnO2 , 稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3﹣>Al(OH)3 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH |
A.②③⑤
B.①②③
C.③④⑤
D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下: Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液 ![]() 无明显现象
无明显现象 ![]() 溶液变红
溶液变红
实验2:0.1mol/L FeCl3溶液 ![]() 溶液变红
溶液变红 ![]() 溶液红色未褪去
溶液红色未褪去
(1)写出Fe(OH)2Cl与盐酸反应的离子方程式 .
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 .
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下: 步骤1:10mL 0.1mol/L KI溶液 ![]() 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液 ![]() 溶液变红
溶液变红
试管2 取3mL黄色溶液 ![]() 溶液变蓝
溶液变蓝
试管3 取3mL黄色溶液 ![]() 取上层溶液
取上层溶液 ![]() 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是 .
②黄色溶液中含有的溶质微粒有K+、Cl﹣ 和 .
③综合上述实验现象,得出的实验结论是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】分析如图所示的四个原电池装置。其中结论正确的是( )
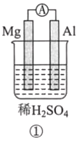
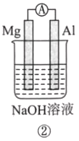
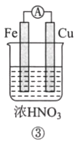
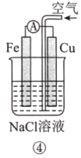
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,OH-向Al电极移动
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为2Na++2e-=2Na
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列关于电解质的说法中正确的是
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多
B. 向NH4Cl溶液中加入少量等浓度的稀盐酸,则![]() 的值减小
的值减小
C. 向NaHS溶液中加入适量 KOH 后:c(Na+)=c(H2S)+c(HS-)+c(S2-)
D. 将a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合(忽略体积、温度变化),所得溶液中c(Na+)=c(CH3COO-),则醋酸的电离常数Ka=![]() (用含a的代数式表示)
(用含a的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】用1L 1mol/L 的NaOH溶液吸收0.8mol CO2 ,则所得溶液中碳酸根和碳酸氢根的物质的量的浓度之比约为
A. 1:3 B. 2:1 C. 2:3 D. 3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪个氧化性更强? 猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
(2)设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的. 供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号) | 实验现象 | |
方案1 | ||
方案2 |
(3)结论 氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 .
(4)实验后的思考 ①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 .
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有 ![]() 的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中不正确的是
A.原子半径:O>S>Cl
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于原电池的叙述中正确的是
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.原电池工作时,实现了将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com