
科目: 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,利用回收的某酸性锌锰干电池,处理可得到多种化工原料,并制备ZnSO4·7H2O。经查询该电池一种一次性电池,外壳为金属锌铁合金,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的填充物,放电过程产生MnOOH。
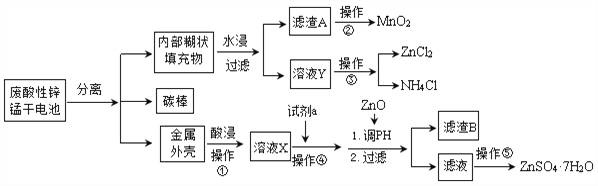
已知:Ksp(Zn(OH)2)=10-17;Ksp(Fe(OH)3)=10-39;![]()
![]() = 4.64 lg2 = 0.3
= 4.64 lg2 = 0.3
回答下列问题:
(1)操作①的酸浸选用的酸为__________(填化学式),溶液X含有的阳离子为_________。
(2)滤渣A进行操作②得到较纯的MnO2,最简便的方法为__________,其原理是________。
(3)操作③和操作⑤,可通过__________、过滤、洗涤、晾干等步骤,分离提纯得到产品。
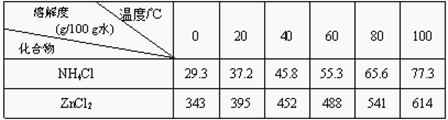
(4)操作④选用的试剂a选用___________(填化学式),其目的是______________________________(用离子方程式表示),继续加 ZnO调节pH,生成氢氧化铁沉淀,铁刚好沉淀完全的pH约为________ (离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)。
查看答案和解析>>
科目: 来源: 题型:
【题目】丹参素的结构简式如下所示,有关它的说法错误的是( )
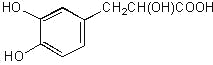
A. 1 mol丹参素能与3mol H2发生加成反应
B. 1 mol丹参素能与4mol NaOH发生反应
C. 能与NaHCO3、Na反应D. 可以发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】利用实验室常用的物品,根据电化学原理,可以设计原电池。请填写下列空白:
(1)实验原理:Fe+2H+= 。
(2)实验用品:电极( 、 )(填所用电极的名称)、稀硫酸、烧杯、导线、耳机(或电流计)。
(3)实验装置如图所示。
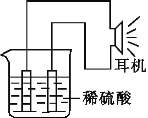
(4)原电池工作原理分析:
该原电池工作时,负极为 (填化学式),发生 (填“氧化”或“还原”),其电极反应式为 ,另一电极为正极,发生 反应,其电极反应式为 ,外电路中电子流动方向为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:

反应前 反应后
(1)该化学反应中生成物的分子个数比为______________;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是__________________________________________________________;
(3)该化学反应的基本类型为_________________________________;
(4)由X原子构成的物质在该反应中____________(填“是”或“不是”)催化剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:

(1)此反应的化学方程式中=___________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________________________。
(3)下列叙述能说明上述反应达到平衡状态的是_________(填字母序号)。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率;
(3)2 min末SO2的转化率。
查看答案和解析>>
科目: 来源: 题型:
【题目】6-硝基胡椒基酸K是合成心血管类药物米络沙星的中间体,在实验室中合成路线如下图所示(部分反应条件已经略去):
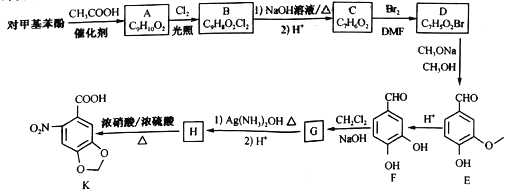
已知:连在同一个碳上的两个羟基易脱水形成羰基。
回答下列问题:
(1)C的名称为_______,H 中官能团的名称为__________。
(2)由C生成D的反应类型为_______,G 的结构简式为_______ 。
(3)由A生成B的化学方程式为_______ 。
(4)R是E的同分异构体,R中有两个取代基,其中一个为羟基且与苯环直接相连,另一个取代基含有“![]() ”,符合条件的R有_____种。其中核磁共振氢谱显示有5种不同类型的氢,且峰的面积之比为2 :2 :2: l: 1的同分异构体的结构简式为________。
”,符合条件的R有_____种。其中核磁共振氢谱显示有5种不同类型的氢,且峰的面积之比为2 :2 :2: l: 1的同分异构体的结构简式为________。
(5)写出以邻苯二酚![]() 和乙醇为原料制备
和乙醇为原料制备![]() 的合成路线____________(其他无机试剂任选)。
的合成路线____________(其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关系曲线不能正确反映其对应变化关系的是( )
A. 加热KClO3和MnO2固体混合物
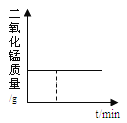
B. 向Ca(OH)2溶液中通入CO2至过量(碳酸钙遇到溶有二氧化碳的水,能生成可溶性碳酸氢钙)
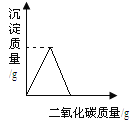
C. 向一定浓度的NaOH溶液中加水稀释
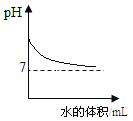
D. 将等质量的Mg和Al分别与过量等浓度的盐酸反应,则a为Mg,b为Al
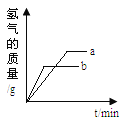
查看答案和解析>>
科目: 来源: 题型:
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
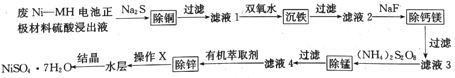
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
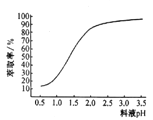
③“操作X”的名称是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com