
科目: 来源: 题型:
【题目】二氯二氢硅(SiH2C12)常作于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl 与硅在250-260℃反应可以制得SiH2Cl2.
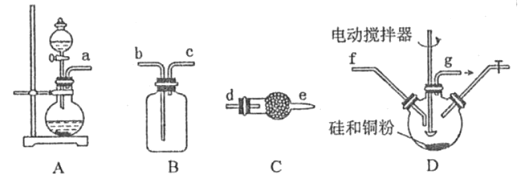
(1) 利用浓硫酸、浓盐酸为原料,选用A 装置制取HC1,利用了浓硫酸的_______性。
(2)D 装置中生成 二氯二氢硅的化学方程式为___________________。
(3) 按照气体从左到右方向,制取SiH2Cl2的装置连接次序为a→___→___→f→g→___→___→____→_____(填仪器接口的字母,其中装置C 用到2 次).其中装置B 的作用是____;前面装置C 中装的药品为______,后面装置C的作用为____________。
(4)新的制取SiH2Cl2 方法是: 往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl 在250-260℃反应,可以大大提高产率。如果通入气体次序相反,产率会降低,其原因是__________(用化学方程式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1) 氧化还原法消除NOx的转化如下:
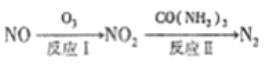
已知: NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则NO 与O3 只生成NO2 的热化学方程式为_____________________。
(2) 有人设想将CO按下列反应除去: 2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?_____( 填“是”或“否”),依据是_____________________。
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000mo1NO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
①结合上表的数据,写出NO与活性炭反应的化学方程式______ 该反应的正反应为_______(填”吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.1000mo1NO,再次平衡后,NO 的体积分数将____。(填“增大”、“减小”或“不变”)。
(4) 用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示。请写出开始时阳极的电极反应式______________。
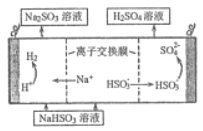
(5)常温下,Ksp(BaCO3) =2.5×10-9,Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) ,该反应平衡常数K的表达式为:K=_______,欲用1LNa2CO3 溶液将0.01molBaSO4 全部转化为BaCO3,则Na2CO3 溶液的最初浓度应不低于_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】t ℃时,0.01 mol/L NaOH溶液pH=11,0.1 mol/LHA溶液中![]() =109。
=109。
(1)该温度下,水的离子积Kw=________,HA是________(填“强”或“弱”)酸。
(2)该温度下,将pH之和为13的NaOH溶液和HA溶液等体积混合后,所得溶液呈_____(填“酸”、“碱”或“中”)性,理由是____________________________________。
(3)在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是________。
A.![]() B.
B.![]() C.溶液中c(H+)和c(OH-)的乘积
C.溶液中c(H+)和c(OH-)的乘积
D.溶液中c(A-)·c(HA)的值 E.水的电离程度
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示:

①图中表示HA溶液pH变化曲线的是________(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1________m2(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列既能和盐酸反应,又能和烧碱溶液反应的物质是
①NaHCO3 ②(NH4)2CO3 ③Al ④Al2O3 ⑤Al(OH)3
A.①②③④⑤B.①③④⑤C.①③④D.①③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸铵NH4ClO4是复合火箭推进剂的重要成分,实验室可通过下列反应制取
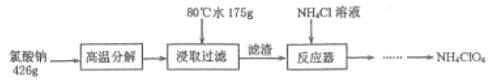
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为___________________________。
(2)反应得到的混合溶液中 NH4ClO4 和 NaCl 的质量分数分别为 0.30 和 0.15, 从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)_______、______、 _______、冰水洗涤、干燥。用冰水洗涤的目的是___________________________________________________。若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是_____________。
(3) 样品中NH4ClO4的含量可用蒸馏法进行则定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
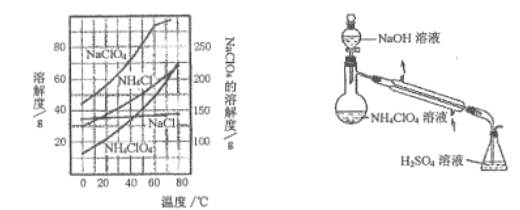
步骤1: 按上图所示组装仪器,检查装置气密性。
步骤2: 准确称取样品a g 于蒸馏烧瓶中,加入150mL 水溶解。
步骤3: 准确量取40.00mL、0.1000mol/L H2SO4溶解于锥形瓶中。
步骤4: 经分液漏斗向蒸馏瓶中加入20.00mL、3mol /LNaOH 溶液。
步骤5: 加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6: 用新煮沸过的水冲洗冷凝装置2--3 次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH 标准溶液滴定剩余H2SO4至终点时消耗NaOH 标准溶液VmL。
①步骤3 中,准确量取40.00mL.H2SO4溶液的玻璃仪器是___________。
②样品中NH4ClO4的质量分数为_______。若取消步骤6,则对定结果的影响是______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3 - |
B | 用洁净的铂丝蘸取某溶液在火焰上灼烧,观察到火焰显黄色 | 该溶液中一定存在Na+,一 定没有K+ |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和 0.1mol/L CH3COONa 溶液的pH | 比较HC1O 和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com