
科目: 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH![]() )/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目: 来源: 题型:
【题目】化学概念相互间存在如下 3 种关系,下列说法不正确的是

A. 电解质与酸、碱、盐属于包含关系
B. 化合物与氧化物属于包含关系
C. 碱性氧化物与酸性氧化物属于并列关系
D. 复分解反应与氧化还原反应属于交叉关系
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】为了充分利用铜资源,某工厂利用废旧黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下:
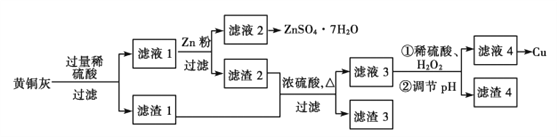
(1)滤渣1的主要成分为__________。稀硫酸溶解黄铜灰过程中,Cu是否参与了反应,如果参与请写出该反应的离子反应方程式,如果没反应请写出理由:_____________________。
(2)滤渣1及滤渣2与浓硫酸反应的步骤中存在缺陷,可将实验改进为先让滤渣与_______反应,产物再溶于稀硫酸,这样改进的优点是_____________________________________。
(3)写出滤液3与H2O2反应的离子反应方程式____________________________________,滤液3反应中需要调节PH的目的是______________________________________________。
(4)25 ℃时,沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如下图所示。
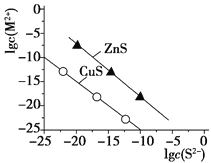
则Ksp(CuS)=_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家韦尔斯泰特,经过10年的艰苦努力,韦尔斯泰特用成吨的绿叶,终于提取到了绿叶中的神秘物质——叶绿素,正是因为叶绿素在植物体内所起到的奇特作用,才使我们人类得以生存。可以说,没有光合作用就没有人类的生存和发展。由于成功地提取了叶绿素,1915年,韦尔斯泰特荣获了诺贝尔化学奖。叶绿素的结构如图
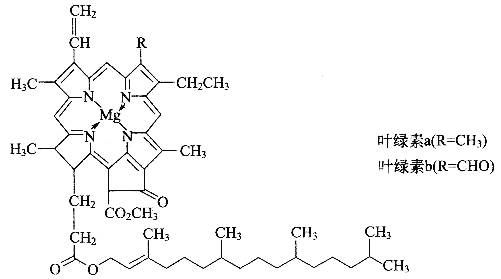
(1)光合作用产生氧气,氧气的一种同素异形体O3,在高空能吸收大量紫外线,保护地球上的人类和动植物免遭短波紫外线的伤害。请写出一种短周期元素形成的O3等电子体分子________,该分子的空间构型为________,中心原子的杂化类型是_________。
(2)镁是叶绿素中的重要组成元素,镁的基态原子价电子排布式为__________,叶绿素中镁形成的化学键类型有___________________。叶绿素不易溶于水,而溶于有机溶剂,如乙醇、丙酮、乙醚、氯仿等,是因为______________________________。
(3)叶绿素构成元素中,又属于二周期元素中,第一电离能由大到小的顺序(请用元素符号表示):_______________,理由是______________________________。
(4)叶绿素的构成元素中,H和Mg属于第一、三周期的元素,能形成一种离子型储氢材料,晶体结构如图所示:
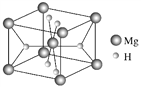
则 该晶体的化学式为__________________,已知该晶体的密度为ρ g·cm-3,晶胞的体积为________ cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1①
C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1②
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______________________________。
(2)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①常温下NaHA溶液的pH________(填序号),原因是____________________________。
A.大于7 B.小于7 C.等于7 D.无法确定
②已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.65 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.93 | 20.00 |
请完成下列填空:
①滴定达到终点的标志是_____________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
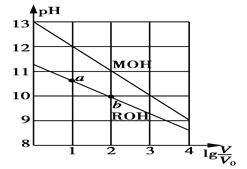
A. MOH为弱碱,ROH为强碱
B. ROH的电离程度:a点大于b点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com