
科目: 来源: 题型:
【题目】最近,国际上提出的“绿色化学”是指化学工业生产中( )。
A.对废水、废气、废渣进行严格处理
B.化学生产中不排放任何有害物质
C.化工厂及周围种草、种树、种花,使工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有Na+、Fe3+、Cl-、SO42-四种离子,已知Na+、Fe3+、Cl-的个数比为3∶2∶1。则溶液中Fe3+和SO42-的个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
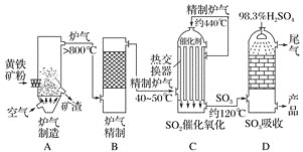
请回答下列问题:
(1)在炉气制造中,黄铁矿粉碎的目的是____________,生成二氧化硫的化学方程式是_____________。
(2)炉气精制的目的是__________________________________。
(3)二氧化硫催化氧化的化学方程式是________________________。
(4)浓硫酸是不是可以用水代替:__________,原因是__________________________________。
(5)尾气的主要成分是__________,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、W、J是7种元素的代号。回答下列问题时,涉及元素书写的请用相应的元素符号。

(1)J基态原子的核外电子排布式为________。基态Q2+中未成对电子数为________;R和Y的简单离子与Na+半径大小顺序为________。
(2)X、Y、Z三种元素电负性由大到小的排序是________;X与Y的第一电离能:X________(填“>”“<”或“=”)Y,其理由是________。
(3)检验某溶液中是否含有Q3+的方法是_____________________________。
(4)已知WX3是一种引爆剂,受撞击时分解为两种单质,则其化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解B.有少量NaOH溶液残留在烧杯里
C.向容量瓶中加水未到刻度线D.称量时误用“左码右物”
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的电子排布式为________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因是________________________________________________________________________。
(3)D元素与氟元素相比,电负性:D________(填“>”“=”或“<”)F,下列表述中能证明这一事实的是______(填选项序号)。
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物CA5含有的化学键类型为________。
(5)B2A4是重要的石油化工原料,B2A4的结构式为________。B2A4通过聚合反应可以生成一种有机高分子化合物,反应方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四种粒子中,半径按由大到小的排列顺序是( )
①基态X的原子结构示意图: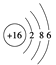 ②基态Y的价电子排布式:3s23p5
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:![]()
④W基态原子有2个能层,电子式: ![]()
A. ③>①>②>④ B. ③>②>①>④ C. ①>③>④>② D. ①>④>③>②
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com