
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示。A 是生活中一种常见的调味品,B 是最常见的无色液体,X、Y是两种常见的金属单质。D、E、F为气体,且 E为黄绿色,F能使品红溶液褪色,E 与 F 以等物质的量反应。请回答下列问题:
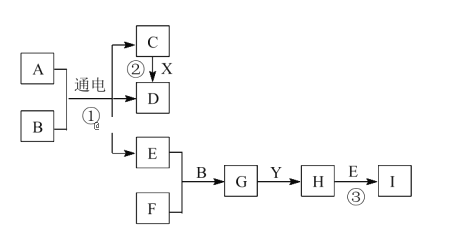
(1)F的化学式是________。溶液 G 中含有的主要离子为_____________(用离子符号表示)。
(2)反应②的化学方程式为___________________。
(3)反应③的离子方程式为________________________________。
(4)请补充完整检验H中阳离子的实验方案:取少量H中的溶液于试管中,_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如下:

回答下列问题:
(1)I中含氧官能团的名称为___________________。
(2)由B生成C的化学方程式为_______________________________。
(3)由E和F反应生成D的反应类型为_______,由G和H反应生成I的反应类型为______。
(4)仅以D为单体合成高分子化合物的化学方程式为_________________ 。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式_________________ 。
(6)参照本题信息,试写出以1-丁烯为原料制取 的合成路线流程图(无机原料任选)__________ 。
的合成路线流程图(无机原料任选)__________ 。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验是化学中的基础实验,请回答有关问题。
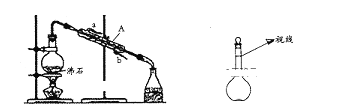
(1)用四氯化碳提取溴水中的溴,所用的分离方法是______,用到的主要仪器是______________,
(2)用图装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有_____,实验时仪器A中冷却水的进口为_______________(选填“a”或“b)
(3)实验室需配制100mL 3.6mol·L—1的稀硫酸。若采用18 mol·L—1的浓硫酸来配制稀硫酸需要用到浓硫酸的体积为_____________,实验中将溶液转移到容量瓶中的正确操作是_________________________。在稀硫酸配制过程中,某同学观察液面的情况如图所示,所配稀硫酸的浓度会____________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求进行填空:
(1)6.20 g Na2O 晶体中含 Na+的物质的量是 _________________。
(2)等质量的 NH3 和 H2S 中,氢原子的个数比是______________________。
(3) 铁与水蒸气反应的化学方程式_______________________________________。
(4) 向少量氯化铝溶液中加入足量氢氧化钠的离子方程式________________________。
(5)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应式为:C6H12O6+6O26CO2+6H2O+能量,该反应中的还原剂是______,若在该反应中消耗氧化剂的体积在标准状况下为4.48L,则反应中转移电子的物质的量为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
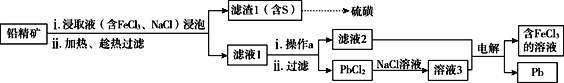
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
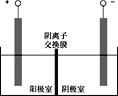
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表前四周期的元素,它们的核电荷数:B<A<C<D<E<F。B、C两种元素都能引起水体富营养化。E原子得到一个电子后3p轨道全充满。A+比E原子形成的离子少1个电子层。D可以形成两种氧化物,其中一种氧化物是形成酸雨的主要气体之一。F的原子序数为26。请回答下列问题:
(1)C、D、E的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)写出B的氢化物与水反应的离子方程式:________________,B的氢化物极易溶于水的原因是____________________________________________________________。
(3)化合物BE3的分子空间构型为________________。
(4)F元素原子的核外电子排布式为________。F的一种常见化合物F(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,则F(CO)5的晶体类型为__________________。
(5)将FE3的饱和溶液滴入沸水中,请写出有关反应的离子方程式:___________________________。
(6)比较B、C两种元素的氢化物稳定性并说明理由:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为54,对应原子最外层电子数之和为20。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,该反应的离子方程式为______________________________________________________。
(2)X与W可形成X2W和X2W2两种化合物,X2W2的电子式为_____________。
(3)Q与W可形成化合物QW2,这种化合物固态时属于________晶体。
(4)Y的硝酸盐水溶液显________性,用离子方程式解释原因___________________。
(5)Z的氢化物与W的氢化物发生反应生成Z的单质和水,其化学方程式为_____________________。
(6)W、X、Y、Z四种元素原子半径由大到小的顺序是:________(用元素符号表示)。
(7)0.5 mol Q的单质与足量的W单质完全反应,放出196.75 kJ的热量。写出该反应的热化学方程式:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
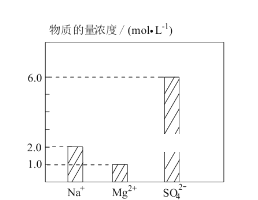
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】人类对原子结构的探究经历了多个历史阶段.下列各阶段的先后顺序正确的是( )
①徳谟克利特提出的古典原子论 ②道尔顿提出的近代原子论
③卢瑟福提出原子结构的“行星模型”④汤姆逊提出原子结构的“葡萄干面包模型”
A.①②③④
B.①②④③
C.①③④②
D.④③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com