
科目: 来源: 题型:
【题目】碘是人体各个系统特别是神经系统发育所不可缺少的微量元素。海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。某课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬独液,然后按以下实验流程提取单质碘:

(1)灼烧海带时需要用到的实验仪器是___________(填标号)。
A.烧杯 B.蒸发皿 C.坩埚 D.三脚架 E.酒精灯 F.泥三角 G.玻璃棒
(2)图中操作①名称为______,操作③名称为__________。
(3)操作③中所用的有机试剂可以是_________(只填一种),理由是________。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.拧开漏斗下面的活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层液体;
G.将分液漏斗上口的玻璃塞打开(或使塞上的凹槽与漏斗上口的小孔对准);
H.静置、分层。
过程③正确操作步骤的顺序是:________(填标号);上述G步操作的目的是:_______。
(5)检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏。观察下图所示实验装置,指出需要改正的地方:_________。

上述蒸馏操作结束后,晶态碘在_________(填仪器名称)里聚集。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. H2分子中含σ键而N2分子中还含π键
B. π键是由两个p轨道“肩并肩”重叠形成的
C. 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D. σ键一定是有s轨道参与形成的
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
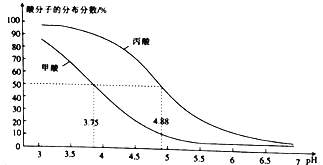
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:

(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式),该气体分子中极性键的数目为___________;“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2==2Al23O27N5+15CO,产物Al23O27N5中氮的化合价为______________________________。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3 (s)+3C(s)==Al2OC(s)+2CO(g)△H1
2Al2OC(s)+3C(s)==Al4C3(s)+2CO(g)△H2
2Al2O3 (s)+9C(s)== Al4C3 (s)+6CO(g)△H3
①△H3=_________(用△H1、△H2表示)。
②Al4C3可与足量盐酸反应制备一种最简单的烃,该反应的化学方程式为__________________________。(3)下列是碳热还原制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(1nK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数。分压=总压×气体的物质的量分数)。

I.Mn3C(s)+4CO2(g) ![]() 3MnO(s)+5CO(g)Kp(I)
3MnO(s)+5CO(g)Kp(I)
II.Mn(s)+CO2(g) ![]() MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s)+CO2(g) ![]() 3Mn(s)+2CO(g)Kp(III)
3Mn(s)+2CO(g)Kp(III)
①△H>0的反应是__________________(填“I”“II”或“I”)。
②1200K时,在一体积为2L的恒容密闭容器中有17.7gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5min内V(CO2)=____________。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡的是____________(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应III,则在A点反应达到平衡。当容器的总压为akPa时,CO2的转化率为______________;A点对应温度下的Kp(III)=____________。
查看答案和解析>>
科目: 来源: 题型:
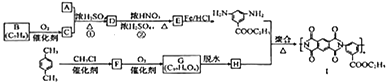
【题目】[化学——选修5:有机化学基础
有机物Ⅰ广泛应用在航空、激光等领城,Ⅰ的一种合成路线如下:
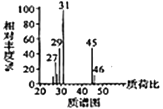
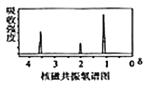
已知:①有机物A的质谱图与核磁共振氢谱图如下:
①2RCOOH![]()
![]() +H2O
+H2O
②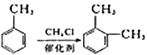
回答下列问题:
(1)A的化学名称是________,C中含氧官能团的名称是________。
(2)②的反应类型为_________,Ⅰ的分子式为_________。
(3)①的反应方程式为_______________________________________。
(4)F的结构简式是______________。
(5)同时满足下列条件的G的同分异构体共有________种(不含立体结构),写出其中的一种结构式:__________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)写出用间二甲苯和甲醇为原料制备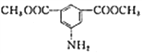 的合成路线:________________(其他试剂任选)。
的合成路线:________________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
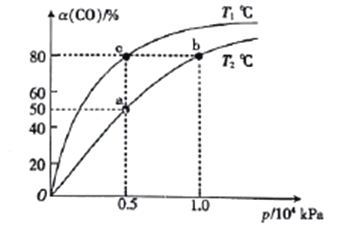
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B. 改变温度,产物中NaCl的最小理论产量为4a mol
C. 参加反应的氯气的物质的量为6a mol
D. 某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或实验操作不正确的是
A. 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中
B. 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出
C. NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热
D. 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
查看答案和解析>>
科目: 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com