
科目: 来源: 题型:
【题目】碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)乙烯具有水果催熟的功效,乙烯的电子式是______________。
(2)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
①其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
②Al4C3是真空碳热还原一氯化法炼铝的中间产物,该物质与水反应生成最简单的有机物。该反应的化学方程式为__________________________________。
(3)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
(4)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)![]() 2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:

①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸在生产生活中有广泛的用途,试回答下列回题:
(1)用浓硫酸在竹简表面“刻字”是利用浓硫酸的________性。
(2)工业上制取硫酸铜常采用铜与稀硫酸混合,通入空气并进行加热,请写出该反应的化学方程式_____________________;不采用铜跟浓硫酸反应来制取硫酸铜的原因是__________________________________。
(3)一定量的锌与含 a mol H2SO4的浓溶液充分反应后,锌完全溶解,同时收集到SO2与H2的混合气体bL(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)为 c mol/L,则混合物中SO2物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的说法中,正确的是( )
A. 苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B. 从苯的凯库勒式( )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C. 在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D. 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物的结构可用键线式简化表示,如CH3-CH=CH-CH3可表示为![]() ,有一种有机物X的键线式如图所示。
,有一种有机物X的键线式如图所示。

(1)X的分子式为_______________________。
(2)有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是_____________。
(3)Y在一定条件下可发生反应生成高分子化合物,该反应的化学方程式是_________________。
(4)Y可以与溴水反应,该反应的化学方程式是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤素元素是非金属性很强的一类元素,能形成多种物质。
(1)氯气能氧化许多种还原剂,同时在适当条件下又可发生自身氧化还原反应。
①将足量的氯气通入到H2S溶液中,再向所得的溶液中加入用盐酸酸化的BaCl2溶液可得到白色沉淀,写出前一个反应的离子方程式:____________________________。
②将0.1molCl2缓慢通入到amL、浓度为2mol/L的KOH溶液中,二者恰好反应完,测得溶液c(ClO-)∶c(ClO3-)∶c(Cl-)=2∶1∶7,则a=______________。
(2)KClO3是一种重要的氧化剂,工业上制备KClO3的方法之一如下:
![]()
①写出电解时反应的化学方程式:_______________________________。
②相同温度下,两种氯酸盐的溶解度相对大小:NaClO3___________KClO3(填“>”或“<”)。
③KClO3在MnO2的催化作用下加热分解生成氧气的反应历程如下,请填写空白处:
2KClO3+2MnO2![]() 2KMnO4+Cl2↑+O2↑;
2KMnO4+Cl2↑+O2↑;
2KMnO4![]() K2MnO4+MnO2+O2↑,
K2MnO4+MnO2+O2↑,
K2MnO4+Cl2![]() O2↑+___________+___________。
O2↑+___________+___________。
反应结束后将固体混合物分离开的主要操作是__________________________。
(3)已知Cl2O是酸性氧化物,将Cl2O通入到水中可得到一种酸性溶液,请写出该溶液具有的除酸性外的一种化学性质______________。若将该气体通入到NaOH溶液中恰好完全反应,则溶液中各离子浓度由大到小的顺序为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。从海带中提取碘的工业生产过程如下,下列说法错误的是

A. 过程①的分离方法是过滤,需要用到的玻璃仪器有漏斗、玻璃棒及烧杯
B. 加入NaOH溶液的目的是使可溶性有机质形成沉淀
C. 在氧化过程中可以选用氯水作为氧化剂
D. 过程②在工业上常采用萃取分液的方法得到碘单质
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,改变0.lmol/L的H2R溶液的pH,溶液中“R”相关的微粒的分布系数δ(X)随pH的变化如图所示[已知![]() ],下列有关说法中正确的是( )
],下列有关说法中正确的是( )

A. pH>2.7时,溶液中c(HR-)<c(R2-) B. 曲线b表示H2R的分布系数
C. K1(H2R)∶K2(H2R)=1000∶1 D. pH=1.2时,2c(R2-)+c(HR-)+c(OH-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两种物质:
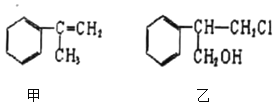
(1)乙中含有的官能团的名称为__________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
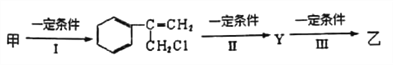
反应I的化学其中反应I的反应类型是____________________,反应II的条件是________,反应III的化学方程式为_________________(不需注明反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现将13.92g的MnO2与150g 36.5%盐酸(盐酸足量)共热,向反应后的溶液加入足量的硝酸银溶液,产生白色沉淀。若不考HCl的挥发,下列说法正确的是
A. 生成AgCl沉淀为0.86mol B. 转移电子数0.64NA
C. 被氧化的HCl为0.32mol D. 产生Cl2 3.584L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com