
科目: 来源: 题型:
【题目】在当下热播的电视剧《人民的名义》中,达康书记正在参加省委召开的“开展垃圾分类,建设美丽厦门”扩大会议。达康书记问环保局长: 下列哪一组垃圾都是可回收垃圾
A. 果皮、旧报纸、废电池 B. 剩饭、鱼骨头、玻璃瓶
C. 饮料瓶、玻璃酒瓶、废作业本 D. 易拉罐、旧衣物、手机电池
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】用焰色反应检验K+时有如下操作步骤:①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察,④用稀盐酸洗净铂丝。其中正确的操作顺序为( )
A.①②③④
B.④①②③
C.④②①②③
D.①③②④
查看答案和解析>>
科目: 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )
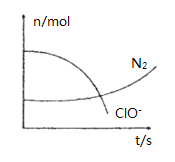
A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,HCO3-是氧化产物
C. 参与反应的氧化剂与还原剂的物质的量之比为5:2
D. 标准状况下若生成2.24LN2,则转移电子1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】I.请根据信息填空:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3 +Cu ===2FeCl2 +CuCl2,若将此反应设计成原电池,则负极所用的电极材料为__________________;当线路中转移0.2mol电子时,则被腐蚀的铜的质量为__________________。
(2)如图所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,可观察到溶液变浑浊,试回答下列问题:

①产生上述现象的原因是___________________________;
②写出有关反应的离子方程式___________________。
③由实验推知,MgCl2溶液和H2的总能量__________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应;
(2)在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应,理论上生成2molNH3时放出或吸收的热量为Q,则Q为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.利用如图装置可验证同主族元素非金属性的变化规律
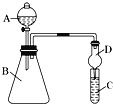
(1)仪器A的名称为______________,干燥管D的作用是______________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,装置C中的实验现象为淀粉溶液变蓝,写出使淀粉溶液变蓝的离子方程式__________________________________________。
(3)实验室中现有药品:①稀盐酸 ②稀硫酸 ③Na2SiO3溶液 ④Na2CO3 ⑤CaCO3固体,请选择合适药品设计实验验证C、Si、S的非金属性的变化规律;装置A、B中所装药品分别为_______、____________。(填序号)
Ⅱ.试用Zn+Cu2+===Zn2++Cu的反应设计原电池。
(1)原电池中使用的电解质溶液是__________________;
(2)写出电极反应式:负极:___________________________;正极______________________________;
(3) 当导线中有6.02×1023个电子通过时,电池负极质量减少____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO,和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。
图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式_____________。
(2) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。

请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N2的电子式________。
② 曲线c对应NH3与NO的物质的量之比是______。
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物: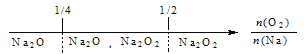
B. 铁在Cl2中燃烧,铁的氧化产物:![]()
C. NH3与Cl2反应,反应产物: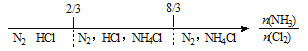
D. FeBr2溶液中通入Cl2,铁元素存在形式: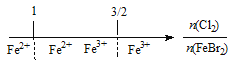
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com