
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电脑显示屏生产过程中有大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)产生。某课题组以此粉末为原料回收铈,设计实验流程如下:
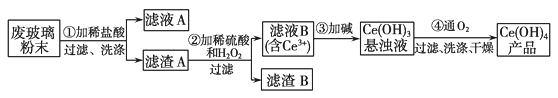
(1)滤渣A的主要成分是_____________;洗涤滤渣A除去的阳离子主要是________(填离子符号),检验该离子是否洗净的操作是________________________;
(2)步骤②中反应的离子方程式是_____________________;
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等;
(4)步骤④中反应化学方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是
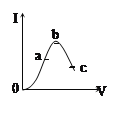
A. a、b、c三点处,溶液中c(H+)由小到大的顺序为a、b、c
B. a、b、c三点处,溶液中CH3COOH分子数:a>b>c
C. a、b、c三点处,c(CH3COO-)最大的是a
D. 若使c点溶液中c(CH3COO-)增大,可采取的措施有加水稀释或加热
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,HCOOH(甲酸)比NH3H2O电离常数大。向10 mL 0.1mol/L HCOOH中滴加同浓度的氨水,有关叙述正确的是( )
A. 滴加过程中水的电离程度始终增大
B. 当加入10 mL NH3H2O时,c(NH4+) > c(HCOO-)
C. 当两者恰好中和时,溶液pH = 7
D. 滴加过程中n(HCOOH)与n(HCOO-)之和保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
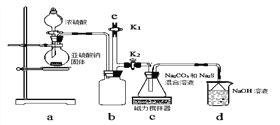
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
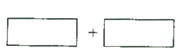
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】制备苯甲酸的反应原理及有关数据如下:

名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 溶解度 |
甲苯 | 92 | 无色液体 | -95℃ | 110℃ | 不溶于水 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122℃ | 248℃ | 微溶于水 |
高锰酸钾 | 158 | 易溶于水 |
实验过程如下: ①将高锰酸钾、水和氢氧化钠溶液混合摇匀后,加入甲苯,采用电磁搅拌,加热(但温度不要太高),冷凝回流2h。如仍有高锰酸钾的紫色存在,则加数滴乙醇。 ②将混合液过滤后冷却。③滤液用盐酸酸化,析出白色晶体过滤,洗涤,干燥,得到苯甲酸的粗产品,最后测定其熔点。回答下列问题:
(1)①中反应易暴沸,本实验中采用______方法防止此现象;乙醇的作用是____________________。
(2)②中过滤出的沉淀是____________________。
(3)③中测定熔点时,发现到130℃ 时仍有少量不熔,推测此不熔物的成分是____________________。
(4)提纯苯甲酸粗产品的方法是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分条件已略去),在通常状况下,B是黑色的金属氧化物,D、E、F是气体单质,C是一种水溶液显碱性的气体,I为红棕色气体,G为紫红色的金属。

(1)B的化学式为__________;A的结构式为___________;
(2)写出反应①的化学方程式:_____________________________;
(3)写出反应②的离子方程式: ___________ ,该反应是________(填“放热”或“吸热”)反应;
(4)实验室制备C时,检验是否收集满C的方法是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。

(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为____,当有1.6g负极材料溶解时,转移的电子为____mol;
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→ __________(填电极材料,下同),溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________________。
Ⅱ.已知H-H 键、N-H 键、N≡N 键的键能分别为 436kJ/mol、391kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
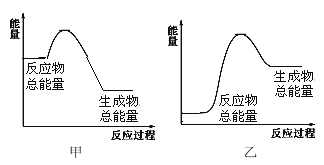
(4)若有 1 mol NH3生成 ,可________(填“吸收”或“放出”)热量________kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com