
科目: 来源: 题型:
【题目】具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(R)的合成路线如下:
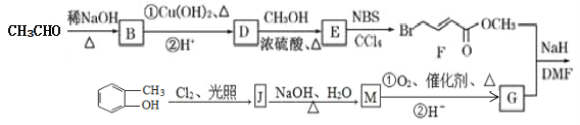

已知: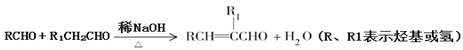
(1)苯并呋喃衍生物(R)的分子式为__________,含有的含氧官能团有________。
(2)E的结构简式为_________________,其核磁共振氢谱峰面积之比为________________。
(3)M→G中反应①的化学方程式为__________________,反应类型是________________。
(4)F与足量氢氧化钠溶液共热反应的化学方程式为_____________________。
(5)化合物G含有苯环的同分异构体有________种,其中苯环上只有一个侧链且能发生银镜反应的结构简式为____________________。
(6)参照上述合成路线,设计以甲苯和乙醛为原料制备苯丙烯酸(![]() )的合成路线____________。
)的合成路线____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下某溶液中由水电离产生的c(H+)等于10-10mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4B.NaClC.HClD.Ba(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. O2分子间存在着非极性共价键 B. SO2和H2O反应的产物是离子化合物
C. CO2分子内存在着极性共价键 D. 盐酸中含有H+ 和Cl,故HCl是离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1,
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1;
SO2通常在NO2的存在下,进一步被氧化,生成SO3。写出NO2和SO2反应的热化学方程式为________________________________。
(2)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的_______(填“正”或“负”)极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
(3)常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____________________________________(写出主要反应的离子方程式),该溶液中c(Na+)_________ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”);
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)- c(H2SO3)= _________ mol/L(填写准确数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物。萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等)。
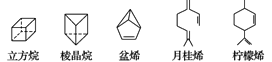
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】VmL Al2(SO4)3溶液中,含有Al3+a g,取V/2 mL溶液稀释到3V mL,则稀释后溶液中SO42-的物质的量浓度是
A. 250a/27V mol·L﹣1B. 250a/27V mol·L﹣1
C. 500a/9V mol·L﹣1D. 125a/27V mol·L﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
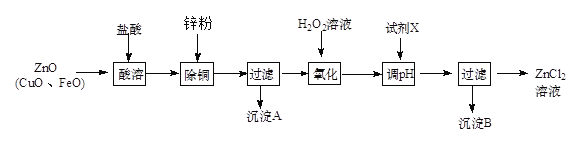
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 用碳酸氢钠溶液检验水杨酸中的羧基: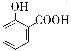 +2HCO3-→
+2HCO3-→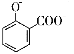 +2H2O+2CO2↑
+2H2O+2CO2↑
B. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3—+Ba2++OH—= BaCO3↓+H2O
C. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH- = MgCO3↓+2H2O
D. 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42- = 2Mn2++10CO2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com