
科目: 来源: 题型:
【题目】已知反应2H2+O2![]() 2H2O放出能量,下列说法中正确的是( )
2H2O放出能量,下列说法中正确的是( )
A. 生成物水所具有的总能量高于反应物氢气和氧气所具有的总能量
B. 反应物氢气和氧气所具有的总能量高于生成物水所具有的总能量
C. 反应物氢气和氧气所具有的总能量等于生成物水所具有的总能量
D. 反应物氢气和氧气具有的能量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是
A.被还原的物质是还原剂
B.氧化剂被还原,还原剂被氧化
C.失去电子,化合价降低的物质是还原剂
D.氧化剂失去电子,化合价升高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A. 酸性:盐酸>氢硫酸(H2S),故非金属性:Cl>S
B. 第二周期元素的最高正化合价从左到右依次升高
C. 共价化合物中只存在共价键离子化合物中一定含有离子键
D. 元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱
查看答案和解析>>
科目: 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为 _____基态铝原子核外电子云形状有_________(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和![]() 键的个数比为_____,分子中碳原子轨道的杂化类型是___
键的个数比为_____,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由
采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由![]() 转变为
转变为![]() 晶体体积_____(填“膨胀”或“收缩”)。
晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__gcm﹣3.
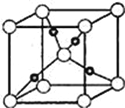
查看答案和解析>>
科目: 来源: 题型:
【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 |
A.C6H14B.C6H12C.C7H12D.C7H14
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)212H2O,其工艺流程图如下:
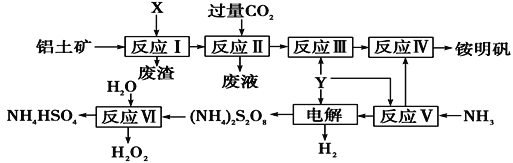
(1)流程图中X为_________(填化学式),Y为______(填名称)溶液,NH3的电子式________;
(2)流程中电解池阳极的电极反应式为______;
(3)反应II的离子方程式为____________________反应Ⅵ的化学方程式为_________________;
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是______;
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯气的说法不正确的是( )
A. 氯气和液氯是两种不同的物质
B. 可以用浓硫酸除去氯气中的水蒸气
C. 氯气是一种有毒气体,但可用于自来水的杀菌消毒
D. 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是(______)(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)下图是从海水中提取镁的简单流程。

①操作A是 _______________________。
②无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_____。
③海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?____。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是(________)(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________________。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是(________)(填字母序号)。
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:_______。
(4)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH = K2CO3+3H2O,则该燃料电池的负极的电极反应为__________________。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率_________(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________mol/L。
③能够说明该反应达到化学平衡状态的标志是_______(双选)。
A.单位时间内消耗1molCO2,同时生成3mol H2
B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化
D.CH3OH和H2O浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式_____________。
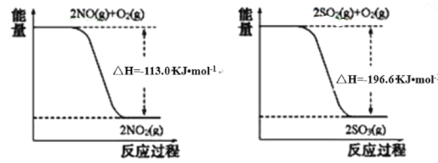
(2)常温下用NaOH溶液吸收SO2,当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,利用图所示装置(电极均为惰性电极)在pH为4~7之间电解,可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸,这是电化学脱硫技术之一,
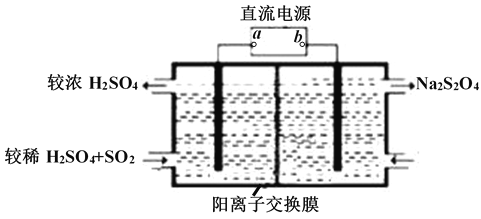
①a为电源的_______(填 “正极”或“负极”);
②阴极的电极反应式为______
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,反应为2Cu + H2O ==Cu2O + H2↑。装置如图所示:该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:____________________,钛极附近的pH_______ (增大、减小、不变)。
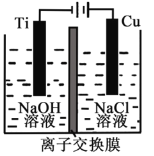
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
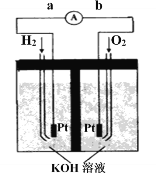
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为_______(用a→b或b→a表示)。
②负极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com