
科目: 来源: 题型:
【题目】关于元素周期表的说法,不正确的是( )
A.元素周期表有7个周期
B.元素周期表中元素的排列依据是原子的核电荷数
C.同周期的元素,最外层电子数相同
D.同主族的元素,最外层电子数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.可用丁达尔效应区分溶液与胶体B.生石灰与水混合的过程只发生物理变化
C.从物质分类看纯碱既是碱又是盐D.CuSO4·5H2O是一种混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水得到酸性溶液,C2D溶于水得到碱性溶液。
(1)E元素在周期表中的位置为_______________;工业上制取C 单质的化学方程式为______。
(2)A的最低负价氢化物的空间构型为___;C、D、E 的简单离子的离子半径由大到小的顺序是__(用离子符号表示)。
(3)化合物C2D3中,该化合物的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为_________________________________________________。
(2)第②步加H2O2的作用是______________________,使用H2O2的优点是_____________。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:

上述三种方案中,_________________方案不可行,原因是____________________,从原子利用率角度考虑,___________方案更合理。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】取不同质量由 Ba(OH)2和 BaCO3组成的均匀混合样品,先加适量的水溶解,然后加入100mL某浓度稀盐酸,所得CO2气 体的体积(己换算为标准状况)与加入样品的质量关系如图所示(不考虑CO2的溶解、反应及碳酸氢盐的生成)。请计算:

(1)混合物中Ba(OH)2和 BaCO3物质的量之比为________。
(2)稀盐酸物质的量浓度为________mo1/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO47H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4FeSO46H2O↓。其流程可表示为:
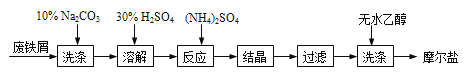
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
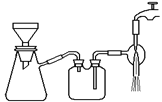
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
②产品中Fe2+的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组同学用下图所示装置在实验室制氯气并探究其相关性质(夹持设备已略)。

(1)制备氯气选用的药品为:漂白粉固体和浓盐酸,相关的化学反应方程式为_______________。
(2)装置B的作用之一是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中①、②、③依次放入_____(选填表中字母)。
① | ② | ③ | |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性强弱。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为________色,说明氯的非金属性大于溴;之后打开活塞,将装置D中少量溶液加入装置E中,振荡;观察到的现象是___________________,则说明溴的非金属性大于碘。
(5)有同学提出该实验方案仍有不足,请说明其中的不足及后果。
①_________________________;②______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计如图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6 mol/L盐酸 d.氯化铵 e.氢氧化钙。

(1)A中制备气体时,所需药品是(选填字母序号)_____________________。
(2)B中盛有饱和碳酸氢钠溶液,其作用是_____________________________。
(3)写出制取氨气的化学方程式:_____________________________________。
(4)在实验过程中,向C中通入气体有先后顺序,先通入气体的化学式是:__________。
(5)检验D出口处是否有氨气逸出的方法是______________________。
(6)写出制纳米级碳酸钙的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com