
科目: 来源: 题型:
【题目】下列粒子(分子或离子)均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离子 | 化合物,双核分子 | 单质,双核分子 | 化合物,三核分子 | 化合物,四核分子 | |
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】0.1 mol/L CH3COOH溶液加水稀释,下列有关稀释后溶液的说法正确的是
A. 电离程度不变
B. 溶液中离子总数增多
C. 溶液导电性增强
D. 溶液中醋酸分子增多
查看答案和解析>>
科目: 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

(1)F的结构简式为__________,C的名称为__________。
(2)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是_______mol;
(3)写出下列反应的化学方程式:
②__________________________________________________________;
③__________________________________________________________;
④__________________________________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为________。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是________(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
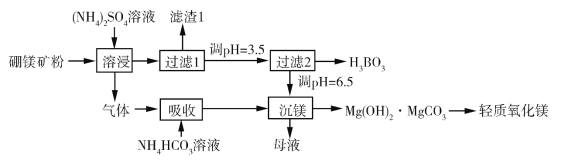
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某化学兴趣小组在实验室用如下装置制备氯气:

请回答:
(1)写出A装置中制取氯气的化学方程式____________________。
(2)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是____________________ (填写数字编号)。
II.某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了方案对废液进行以下三步处理,并回收金属。

请回答:
(1)步骤①中得到的沉淀含有的金属单质有__________。
(2)步骤②是将Fe2+转化为Fe3+,还可以选用的试剂是_____。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步骤③中加入氨水生成红褐色沉淀的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com