
科目: 来源: 题型:
【题目】一定温度下,有![]() 盐酸;
盐酸;![]() 硫酸;
硫酸;![]() 醋酸三种酸的稀溶液
醋酸三种酸的稀溶液![]() 用a、b、c、
用a、b、c、![]() 、
、![]() 、
、![]() 号填写
号填写![]()
![]() 当其物质的量浓度相同时,
当其物质的量浓度相同时,![]() 由大到小的顺序是____________,
由大到小的顺序是____________,
![]() 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
![]() 当其
当其![]() 相同时,物质的量浓度由大到小的顺序为____________,
相同时,物质的量浓度由大到小的顺序为____________,
![]() 当
当![]() 相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气![]() 相同状况
相同状况![]() ,则开始时反应速率的大小关系是____________.
,则开始时反应速率的大小关系是____________.
![]() 将
将![]() 相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍,![]() 由大到小的顺序为_____________.
由大到小的顺序为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学降解![]() 的原理如图所示。下列说法不正确的是
的原理如图所示。下列说法不正确的是

A. 铅蓄电池的负极反应为:Pb - 2e-+ SO42- =PbSO4
B. 电解一段时间后,若不考虑溶液体积变化,交换膜左侧溶液酸性增强,右侧溶液酸性减弱
C. 该电解池的阴极反应式为2NO3-+12H++10e-=N2↑+6H2O
D. 若电解过程中转移2mole-,则质子交换膜左侧电解液的质量减少Δm(左) =18.0g
查看答案和解析>>
科目: 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
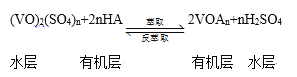
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合下图回答问题。

①此反应的热化学方程式是______
②反应活化能:过程I___过程II(填“>”“=”或“<”)
③过程II温度—转化率图如下,下列说法合理的是_____

a.甲醇脱氢法制备甲醛过程无副反应发生
b.温度高于 650℃催化剂烧结,活性减弱
c.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为____,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为_____mg。

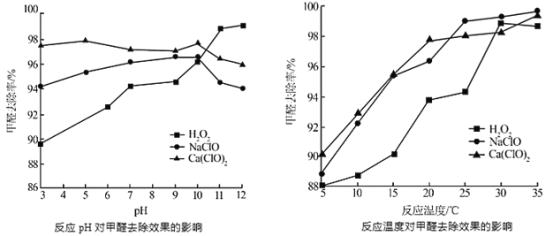
②氧化剂可处理甲醛污染,结合以下图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为______
查看答案和解析>>
科目: 来源: 题型:
【题目】以苯酚为主要原料,经下列转化可合成高分子材料C和重要的有机合成中间体H(部分反应条件和产物已略去)

已知:R1CH2COOCH3+R2COOCH3 +CH3OH
+CH3OH
请回答下列问题:
(1)A→B的反应类型是___________。
(2)B→C的化学方程式为_________。
(3)D的官能团名称是_________。
(4)E→F的化学方程式为_______。
(5)G的结构简式是_________。
(6)F→G为两步反应,中间产物的结构简式是_______。
(7)芳香化合物M(C8H10O2)与E的水解产物互为同分异构体,1molM可与2 mol NaOH反应,其核磁共振氢谱中有3组峰且峰面积之比为3:1:1,则M的结构简式是_________(写出一种即可)。
(8)以CH3Cl、CH3ONa、NaCN为原料(其它无机试剂任选),结合题目已知信息,写出制备CH3COCH2 COOCH3的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K=1.75×10-5
次氯酸K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式:K1=________。
(2)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________(填字母,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(3)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===![]() +HClO
+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-===![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) ![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com