
科目: 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中有HCHO、H2和O2混合气体共10 g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4 g,则原混合气体中O2的质量分数是
A.40% B.33.3% C.60% D.36%
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
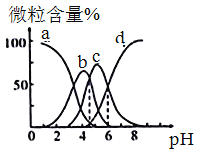
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. Na2HR溶液中HR2-的水解程度大于电离程度
C. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的元素符号:B____,D_______,F_______。
(2)用电子式表示B、F形成的化合物_______。
(3)A、C两种元素最高价氧化物的水化物之间反应的化学方程式为______________________________________,C、F两种元素最高价氧化物的水化物之间反应的离子方程式为___________________________________________。
(4)F的氢化物的形成过程可表示为_________________________________________,该氢化物的稳定性比D的氢化物稳定性_________(填“强”或“弱”)。
(5)简述比较B与C金属性强弱的实验方法:_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。

(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是
2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是
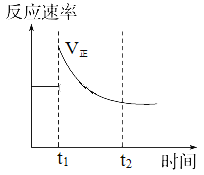
A. t1时降低了温度,平衡向正反应方向移动
B. t1时增大了压强,平衡向正反应方向移动
C. t1时增大了N2的浓度同时减小了NH3的浓度,平衡向正反应方向移动
D. t1时可能使用了催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
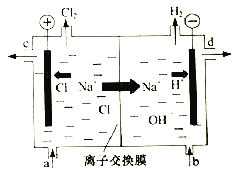
完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________________________。
(2)阳极发生的是____________反应、阴极发生的是________反应(填“氧化”或“还原”)。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是____________(元素符号作答),当生成标准状况下35.84 L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为10 L的反应室,CH4的平衡转化率与温度、压强的关系如图所示。

①若达到A点所需的时间为5 min,则v(H2)=____________________。
②图中的p1______p2(填“<”“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是_______。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列措施中能使
CO2(g)+H2(g) ΔH<0,下列措施中能使![]() 增大的是________(选填编号)。
增大的是________(选填编号)。
A.降低温度 B.恒温恒容下充入He(g)
C.将H2从体系中分离 D.再通入一定量的水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com