
科目: 来源: 题型:
【题目】氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):
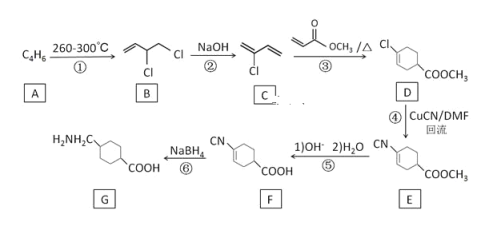
回答下列问题:
(1)A的结构简式是________。
(2)C的化学名称是__________。
(3)②的反应类型是________。
(4)E中不含N原子的官能团名称为_______。
(5)氨甲环酸(G)的分子式为________。
(6)写出满足以下条件的所有E的同分异构体的结构简式:________。a.含苯环 b.含硝基 c.核磁共振氢谱有三组峰
(7)写出以![]() 和
和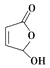 为原料,制备医药中间体
为原料,制备医药中间体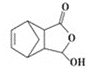 的合成路线:__(无机试剂任选)。
的合成路线:__(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
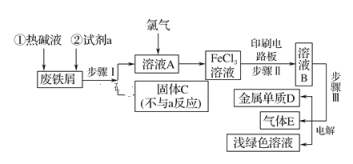
(1)热碱液的作用_____________;
(2)试剂a应选用________(填写名称);
(3)步骤Ⅰ用到的主要玻璃仪器有漏斗、_____(填写仪器名称);
(4)写出步骤Ⅱ中主要反应的化学方程式______;
(5)实验室制取气体E的离子方程式是____,欲对气体E进行干燥和吸收,需选用下列装置中的____(填写序号);
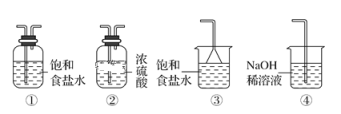
(6)如何用化学方法检验气体E?_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+Cl2=2HCl
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
D.Zn+H2SO4=H2↑+ZnSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】
(1)在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个N2,含分子数最多的是______(填序号,下同),含电子数最多的是________,质量最大的是______,体积最小的是______;密度由小到大的顺序为________________。
(2)0.5mol某固体A的质量是40g,A的摩尔质量为_________。
(3)质量之比为8∶7的两种气体O2、CO,其分子数之比为_______________;氧原子数之比为____________;相同条件下的体积之比为________。
(4) 4.8g碳在一定量的氧气中燃烧,反应后生成CO和CO2的总质量为12.8g。则在同温同压下,生成的CO和CO2的体积比为__________。
(5)由NaHS,MgSO4,NaHSO3组成的混合物中,硫元素的质量分数为a%,则混合物中氧元素的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下图中仪器的名称:a.____,b.____。
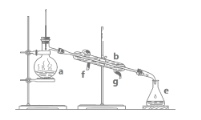
(2)若利用上图装置分离四氯化碳和酒精的混合物,还缺少的仪器是_______,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(3)现需配制0.1mol/L NaOH溶液450mL,下图是某同学转移溶液的示意图。

①图中的错误是__________。
②根据计算得知,需称量NaOH的质量为_____。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④若实验遇下列情况,溶液的浓度是偏大、偏小还是无影响.
A.溶解后没有冷却便进行定容__________________;
B.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀___________________;
C.定容时俯视容量瓶的标线___________________;
D.容量瓶内壁附有水珠而未干燥处理___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:______。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:________。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团:______________________。
(4)A的核磁共振氢谱如下图:则A中含有__________种氢原子。
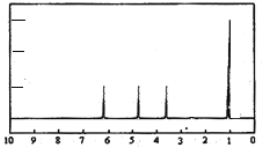
(5)综上所述,A的结构简式_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D 四种化合物,分别由K+ 、Ba2+ 、SO42 、CO32、OH中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式:
A____________;B____________;C_____________;D____________。
(2)写出下列反应的离子方程式:
C与盐酸反应___________________________________________________
B与盐酸反应_______________________________________________________
过量的E与澄清石灰水反应___________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是____和______。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为___。(填名称)
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为_________(化学式),写出Cu溶解的离子方程式_______,若要将Cu完全溶解,至少加入H2SO4的物质的量是_________。
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上:a、萃取分液法;b、加热分解; c、结晶法; d、分液法; e、蒸馏法; f、过滤法; g、渗析法
①_____从硝酸钾和氯化钠的混合溶液中获得硝酸钾
②______分离水和苯的混合物
③_____除去氢氧化铁胶体中混有的NaCl
④______分离碘和四氯化碳
(2)实验室用4.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
①实验需要玻璃棒、胶头滴管、烧杯、量筒外,还需要的玻璃仪器是____________。
②配制上述溶液,需要4.0 mol/L NaCl溶液_________mL。
③配制过程中出现以下情况,使所配溶液浓度偏低_____________。
A.溶液转移后没有洗涤烧杯和玻璃棒。 B.定容时仰视容量瓶的刻度线。
C. 未冷却即进行转移、定容操作。 D.容量瓶中原有少量蒸馏水
E.如果加水超过了刻度线,取出溶液使液面恰好到刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com